Tamizaje de Aspergillus fumigatus resistente a los triazoles mediante placas de agar
Descripción
Una forma de tamizar los aislados de A. fumigatus para detectar la resistencia a los azoles es usar un ensayo con placa de agar con fármacos antifúngicos incluidos. El crecimiento en el agar con antifúngicos sería un indicio de resistencia.
Este ensayo se basa en el ensayo recomendado por el Comité Europeo de Pruebas de Sensibilidad a los Antimicrobianos (EUCAST) [Inglés]external icon. Todo aislado identificado por este ensayo deberá analizarse utilizando una prueba de sensibilidad a antifúngicos tradicional, como la microdilución en caldo o la difusión con tiras de gradiente de concentración.
Obtenga más información [Inglés] sobre la resistencia a antifúngicos en Aspergillus.
Los Centros para el Control y la Prevención de Enfermedades están interesados en recibir aislados de A. fumigatus resistentes a los azoles en los Estados Unidos con fines de vigilancia. Usted se puede comunicar con la Subdivisión de Enfermedades Micóticas acerca de los aislados resistentes, enviando un mensaje a aspergillus@cdc.gov.
Versión en PDF – Inglés pdf icon[ PDF – 444 KB]
1.0 Propósito/Principio
El moho ambiental Aspergillus fumigatus es la causa primaria de la aspergilosis invasiva. En los pacientes con afecciones de alto riesgo, la mortalidad supera el 50 %. Los antifúngicos triazoles han mejorado la supervivencia en gran medida; sin embargo, las infecciones por A. fumigatus resistentes a los triazoles se están reportando cada vez más en todo el mundo, y se asocian a un aumento en el fracaso de tratamientos y la mortalidad.
Se usará este procedimiento para tamizar aislados de Aspergillus fumigatus con el fin de detectar la resistencia a antifúngicos azólicos, utilizando placas de agar de 4 cuadrantes con antifúngicos. Comprender la prevalencia en pacientes de este tipo de aislados es importante para guiar la toma de decisiones a nivel clínico y de salud pública. La resistencia a los triazoles debe confirmarse mediante pruebas que utilicen microdilución en caldo.
2.0 Alcance
Si bien este medio puede usarse para el tamizaje de cualquier especie de Aspergillus con el fin de determinar su resistencia a los azoles, este procedimiento se ha escrito principalmente para su uso con A. fumigatus.
Este procedimiento describe cómo: 1) crear las placas de cuatro cuadrantes, 2) procesar los aislados, 3) inocular las placas con Aspergillus y registrar los resultados, y 4) almacenar los aislados.
5.0 Reactivos, suministros, medios
Agar Sabouraud con dextrosa (Emmons). Ejemplo: Fisher Scientific (Producto # L21827) o equivalente Agua estéril de grado molecular
Tween-20. Ejemplo: Fisher Scientific (Producto # BP337-100) o equivalente
Voriconazol. Ejemplo: Sigma (catálogo # PZ0005)
Itraconazol. Ejemplo: Sigma (catálogo # I6675)
Posaconazol. Ejemplo: Sigma (catálogo # SML2287)
Tubos de vidrio estériles con tapa
Concentrado de desinfectante Lysol (Fisher Scientific, catálogo # NC974686) o equivalente
5.1
Medio RPMI:
Las placas para el tamizaje de Aspergillus contienen cuatro cuadrantes con agar RPMI 1640 con glucosa al 2 %: un pozo de control de crecimiento antifúngico, un pozo con voriconazol, un pozo con itraconazol y un pozo con posaconazol. RPMI 1640 en polvo, 10.4g/L (Sigma Aldrich #R1383) o equivalente MOPS, en polvo (Sigma Aldrich #M1254 o equivalente), 34.5 g/L NaOH, 1 mol/L Bacto Agar, 15 g/L (para medios sólidos) D-Glucosa, 20 g/L
- Disolver RPMI, MOPS y glucosa en 450 ml de H2O destilada; ajustar el pH a 7.0 con NaOH.
- Esterilizar con un filtro de 0.2 micrones (nunca esterilizar MOPS en autoclave) y calentar lentamente a 50 ⁰C en baño María.
- Añadir 15 g de agar a 400 ml de H2O de grado molecular y esterilizar en autoclave por 20 minutos. Se debe añadir una barra de agitación antes de esterilizar en autoclave.
- Colocar la solución de agar —esterilizada en autoclave— en baño María a 50 ⁰C y dejar que se enfríe hasta 50 ⁰C.
- Añadir la solución de agar —esterilizada en autoclave— a la solución de RPMI esterilizada; ajustar el volumen final a 1 L con H2O estéril destilada en el agitador magnético.
- Si se utiliza solo un mismo lote del medio, este puede dividirse en alícuotas de 250 ml y se podrá añadir más adelante el fármaco que se usará para el tamizaje de los aislados. Las alícuotas deben colocarse en matraces estériles con barras agitadoras estériles para que puedan agitarse cuando se añadan los fármacos.
Voriconazol: concentración final de 2 mg/L
Itraconazol: concentración final de 4 mg/L
Posaconazol: concentración final de 0.5 mg/L
- Añadir el fármaco en polvo mientras el medio esté a 50 °C.
- Disolver el polvo en el medio usando un agitador magnético y una barra agitadora estéril. Si el agar comienza a enfriarse, colocarlo de nuevo en el baño María a 50 °C.
- Cada placa tendrá un pozo de control, un pozo con voriconazol, un pozo con itraconazol y un pozo con posaconazol. Si los cuadrantes o pozos no tienen etiquetas, colocarlas para que sirvan de orientación. Usar el mismo patrón y orden para todas las placas a fin de facilitar la interpretación.
- La cantidad de medio dividido en partes iguales en cada pozo dependerá de la placa que se utilice. Seguir las instrucciones del fabricante para determinar qué cantidad de medio debe añadirse a cada pozo.
- Almacenar las placas de cuadrantes con medio y antifúngicos a 4 °C. Las placas deberán usarse dentro de 12 semanas (o hasta que el control de calidad detecte una falla).
7.1
El equipo de protección personal estándar debe cumplir con las directrices institucionales, pero como mínimo debe constar de batas, guantes y gafas de protección que deben mantenerse puestos en todo momento.
7.2
Los aislados de Aspergillus deben manipularse en una cabina de bioseguridad certificada, bajo condiciones de BSL 2.
7.3
Las superficies y los suministros deben descontaminarse con una solución de Lysol de 1:128 u otro descontaminante para mohos (hongos) que esté aprobado por su institución.
8.0 Aislados de control de calidad
Los aislados de control de calidad deben hacerse crecer en tubos inclinados con agar Sabouraud con dextrosa (Emmons) y deben analizarse frescos cada vez que se realice la prueba. Se pueden usar cultivos en agua para el almacenamiento a largo plazo, según lo descrito abajo. Preparar varias soluciones madre para cada control a fin de evitar utilizar el mismo tubo una y otra vez, y arriesgar la contaminación de la solución madre.
8.1
Cepas de control (se puede hacer un pedido al Banco de Cepas Resistentes a Antimicrobianos de los CDC y la FDA; https://wwwn.cdc.gov/arisolatebank/):
Aislado de Aspergillus fumigatus resistente a los azoles
Aislado de Aspergillus fumigatus sensible a los azoles
9.0 Procesamiento de las muestras
Este protocolo presupone que los aislados que se tamizarán ya han sido identificados como A. fumigatus. Esto se puede lograr visualmente (si bien de este modo solo se identificará hasta el complejo de especies de A. fumigatus), por secuenciación del ADN del gen de la beta tubulina, o por MALDI-TOF con A. fumigatus en la base de datos.
9.1
Asignar un número de identificación a cada aislado, conforme al sistema de numeración de su laboratorio.
9.2
Subcultivar los aislados transfiriéndolos a un tubo inclinado de agar Sabouraud con dextrosa utilizando un asa estéril, e incubar a 35 °C. La tapa del tubo inclinado debe cerrarse lo suficiente como para que contenga las esporas, pero no tanto como para que no pueda ingresar aire en su interior.
9.3
Los aislados de control de calidad (tanto los resistentes como los sensibles a los azoles) deben subcultivarse al mismo tiempo que cada grupo de aislados analizados.
9.4
Después de 3-7 días de crecimiento, los aislados que estén produciendo conidias estarán listos para los próximos pasos; el tubo inclinado se usará tanto para crear una solución madre de agua como para el análisis de sensibilidad.
9.4.1
El moho que tenga esporas visibles de color verde o azul oscuro estará listo para el uso.
9.4.2
El moho que permanezca blanco —y no se haya vuelto verde— quizás no esté produciendo conidias. Hacer una preparación con azul de lactofenol para ver en el microscopio si hay conidias presentes.
9.4.3
Si el moho es de cualquier otro color —que no sea verde—, quizás no sea A. fumigatus y no se incluirá en el estudio.
9.4.4
Si no hay conidias presentes, reinocular el cultivo en un tubo inclinado fresco. Si todavía no se vuelve verde, procesar con las pocas conidias que estén presentes o enviarlo a un laboratorio de referencia para pruebas complementarias. Con frecuencia, los aislados de Aspergillus que se obtienen de pacientes y que no producen esporas han sido tratados a largo plazo con un antifúngico y son resistentes a los azoles.
10.1
Hacer una solución madre de diluyente agregando 1 ml de Tween 20 a 50 ml de agua de grado molecular.
10.2
Dentro de la cabina de bioseguridad, añadir 2 ml de solución de agua/Tween 20 a un cultivo puro que tenga 3-7 días de crecimiento. El Tween 20 ayudará a la suspensión de las conidias de Aspergillus, que de otro modo podrían simplemente flotar en la superficie.
10.3
Añadir el líquido lenta y suavemente, teniendo cuidado de no perturbar las esporas y permitirles que se dispersen en el aire.
10.4
Volver a colocar la tapa, cerrarla firmemente y agitar el tubo con suavidad, permitiendo que la solución de agua y Tween desprenda las conidias del cultivo puro. Como resultado, el líquido en el tubo debe volverse turbio y oscuro.
10.5
Si el líquido en el tubo no se vuelve turbio, usar un asa plástica de inoculación, estéril, para frotar suavemente la superficie del micelio a fin de desprender las conidias hacia la solución. Tener cuidado para que las hifas no se desprendan del micelio. Solo debe aplicarse una presión suave.
10.6
Usar una pipeta para transferir 1 ml de la suspensión conidial a un tubo criovial con tapa de rosca. Etiquetar el tubo y almacenarlo a temperatura ambiente. Las conidias en este tubo (solución madre de agua) permanecerán viables por al menos 5 años. Algunas se han recuperado hasta 10 años después.
11.1
Retirar del refrigerador las placas de tamizaje de Aspergillus y permitir que alcancen la temperatura ambiente.
11.2
Colocar 2 ml del agua de grado molecular estéril en un tubo de ensayo Pyrex estéril de 13 x 100 mm, con tapa.
11.3
Usar el agua residual del cultivo puro descrito en los pasos 10.1-10.4 para realizar el próximo paso.
11.4
Usar una pipeta para transferir 1-2 gotas de la suspensión de conidias a los 2 ml de la solución y mezclar con vórtex.
11.5
Comparar visualmente la suspensión con el estándar de McFarland 0.5 y hacer ajustes según lo descrito en 11.6 hasta que la suspensión coincida visualmente con el estándar.
11.6
El ajuste se logra añadiendo más agua si la suspensión está demasiado turbia, o más suspensión conidial si el nivel de turbidez es demasiado bajo. Esto producirá una suspensión de solución madre de aproximadamente 1-5 x 106 células por ml.
11.7
La suspensión ya está lista para la inoculación de una placa de tamizaje de Aspergillus. (Ver la figura de abajo).
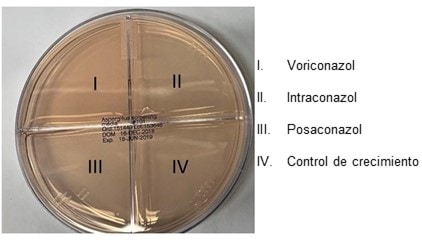
11.8
Mojar el hisopo de algodón estéril en la suspensión de conidias diluidas y pasar por la superficie entera de un cuadrante, de un lado al otro. Volver a mojar el hisopo y pasar por cada uno de los tres cuadrantes que resten. Se debe pasar primero por el cuadrante que no contenga fármacos, pero después el orden no importa.
11.9
Incubar la placa a 35-37 °C por 48 horas.
12.1
El pozo de control de crecimiento debe producir crecimiento (ver el ejemplo de abajo) para que se pueda validar el resto de los resultados. Cada pozo se marcará como “con crecimiento” o “sin crecimiento” en la documentación. A los efectos de este ensayo, cualquier cantidad de crecimiento en los pozos o cuadrantes con fármacos cuenta como crecimiento.


12.2
En el ejemplo de arriba, a continuación de la imagen en 11.7, la placa de la izquierda estaría marcada como sensible a los azoles, y la placa de la derecha sería marcada como resistencia presunta al itraconazol.
13.1
La resistencia de los aislados que puedan crecer en presencia de cualquier fármaco azólico debe confirmarse por medio de la microdilución en caldo, siguiendo las directrices del CLSI en los documentos M38 y M61.
Instituto de Estándares Clínicos y de Laboratorio. 2017.
M38: Método de referencia para el análisis por dilución en caldo de la sensibilidad a antifúngicos de los hongos filamentosos, 3.a edición. Instituto de Estándares Clínicos y de Laboratorio, Wayne, PA.
Instituto de Estándares Clínicos y de Laboratorio. 2017.
M61: Estándares de desempeño para el análisis de sensibilidad a antifúngicos de los hongos filamentosos, 1.a edición. Instituto de Estándares Clínicos y de Laboratorio, Wayne, PA.
El Comité Europeo de Pruebas de Sensibilidad a los Antimicrobianos (EUCAST) también tiene un estándar publicado para la realización de tamizajes de la resistencia a los azoles. El estándar está publicado en este documento:
Guinea J, Verweij PE, Meletiadis J, Mouton JW, Barchiesi F, Arendrup MC; Subcommittee on Antifungal Susceptibility Testing (AFST) of the ESCMID European Committee for Antimicrobial Susceptibility Testing (EUCAST). How to: EUCAST recommendations on the screening procedure E.Def 10.1 for the detection of azole resistance in Aspergillus fumigatus isolates using four-well azole-containing agar plates. Clin Microbiol Infect. 2019 Jun;25(6):681-687.
Descargo de responsabilidad: El laboratorio de la Subdivisión de Enfermedades Micóticas ha creado este documento como ejemplo del procedimiento para pruebas de tamizaje con el fin de identificar “Aspergillus fumigatus” resistente a los triazoles, mediante el uso de placas de agar. El laboratorio que realice las pruebas tiene la responsabilidad de asegurarse de que el contenido y el formato se modifiquen según sea necesario para cumplir con los requisitos reglamentarios correspondientes, los estándares del sistema de gestión de calidad, y los requisitos de seguridad química, radiológica y biológica. Este no es un documento controlado y los métodos de prueba descritos están sujetos a cambios sin notificación previa. El laboratorio que realice las pruebas tiene la responsabilidad de garantizar que la información incluida en este documento siga vigente. Comuníquese con el encargado del desarrollo de pruebas en gyi2@cdc.gov para averiguar si se han hecho cambios.
El uso de marcas registradas y fuentes comerciales se realiza solo con propósitos de identificación y no constituye respaldo alguno del Servicio de Salud Pública, el Departamento de Salud y Servicios Humanos de los Estados Unidos ni de los Centros para el Control y la Prevención de Enfermedades.

