Estimation du nombre de cas futurs de maladie à virus Ebola pendant l’épidémie — Liberia et Sierra Leone, 2014–2015
Auteur correspondant : Martin I. Meltzer, National Center for Emerging and Zoonotic Infectious Diseases (Centre national pour les maladies infectieuses zoonotiques et émergentes), CDC. Courriel : qzm4@cdc.gov ; Téléphone : 404.639.7778.
Résumé
Les premiers cas de l’épidémie actuelle de maladie à virus Ebola (ci-après désignée Ebola) sévissant en Afrique de l’Ouest ont été signalés le 22 mars 2014, dans un rapport faisant état de 49 cas en Guinée. Dès le 31 août 2014, un chiffre total de 3 685 cas probables, confirmés et suspectés en Afrique de l’Ouest avait été rapporté. En vue d’aider à la programmation d’interventions supplémentaires pour le contrôle de la maladie, le CDC a créé un outil de modélisation appelé EbolaResponse destiné à fournir une estimation des nombres possibles de cas futurs. Si la tendance continue sans élargissement de l’échelle des interventions effectives, dès le 30 septembre 2014 un nombre approximatif de 8 000 cas d’Ebola seront recensés en Sierra Leone et au Liberia. Il a été également calculé un facteur de correction des erreurs de sous-estimation possible du nombre de cas rapportés, établi à 2,5. Lorsqu’on utilise ce facteur de correction, le modèle estime qu’au 30 septembre 2014, un total d’environ 21 000 cas aura été recensé au Liberia et en Sierra Leone. Les cas rapportés au Liberia doublent tous les 15–20 jours, et ceux en Sierra Leone doublent tous les 30–40 jours. L’outil de modélisation EbolaResponse a également été utilisé pour estimer comment les interventions de contrôle et de prévention pourraient ralentir et finir par mettre un terme à l’épidémie. Dans un scénario hypothétique, l’épidémie commence à diminuer, puis finit par être endiguée dès lors qu’environ 70 % des personnes atteintes d’Ebola se trouvent dans des établissements de soins ou des unités de traitement d’Ebola (Ebola treatment units, ETU) ou, lorsque ces établissements ont atteint le maximum de leur capacité, dans un cadre non-ETU apte à réduire le risque de transmission de la maladie (notamment par l’inhumation sécurisée, le cas échéant). Dans un autre scénario hypothétique, tous les retards de 30 jours jusqu’à ce que l’augmentation du pourcentage de patients dans les ETU atteigne 70 % ont été associés au triplement approximatif du nombre de cas quotidiens survenant au pic de l’épidémie (néanmoins, l’épidémie finit toujours par être endiguée). Les autorités ont mis au point un plan visant à augmenter rapidement la capacité des ETU, et développent actuellement des méthodes innovantes pouvant rapidement élargir l’échelle des isolements de patients dans des cadres non-ETU de sorte à interrompre la transmission d’Ebola dans les communautés. Le gouvernement des États-Unis et des organisations internationales ont récemment annoncé des engagements pour soutenir ces mesures. Si ces mesures sont rapidement mises en œuvre et perdurent, les prévisions les plus élevées présentées dans le présent rapport deviennent alors très improbables.
Introduction
Les premiers cas de l’épidémie actuelle de maladie à virus Ebola (ci-après désignée Ebola) en Afrique de l’Ouest ont été signalés le 22 mars 2014, avec 49 cas rapportés en Guinée (1).*,† Dès le 31 août 2014, L’Organisation Mondiale de la Santé avait rapporté 3 685 cas probables, confirmés et suspectés en Afrique de l’Ouest, avec 2 914 cas en Sierra Leone et au Liberia, et 771 cas en Guinée (2). En vue de contribuer à la programmation d’interventions supplémentaires pour le contrôle de la maladie, il a été mis au point un outil de modélisation appelé EbolaResponse, destiné à fournir des estimations des nombres possibles de cas futurs.
Méthodes
Le CDC a mis au point l’outil de modélisation EbolaResponse sur une feuille de tableur (disponible sur le site http://dx.doi.org/10.15620/cdc.24900) en utilisant Microsoft Excel 2010, et a utilisé le modèle pour estimer l’augmentation des cas d’Ebola au Liberia et en Sierra Leone (voir l’Annexe pour obtenir des résultats supplémentaires et des notes techniques). De même que pour les modèles Ebola antérieurs (3,4), EbolaResponse suit les patients à travers les stades d’évolution de l’infection et de la maladie en lien avec Ebola : susceptibilité pour la maladie, patient infecté, période d’incubation, patient infectieux, et guéri. L’état infectieux comprend aussi les personnes décédées, mais dont l’inhumation suscite un risque de transmission ultérieur. Le risque associé à l’inhumation non sécurisée fait partie du risque quotidien total de transmission pour les patients à domicile sans isolement effectif (Annexe [Tableau 1]). Toutes les personnes infectées sont supposées finir par développer les symptômes. Les données provenant de rapports sur les flambées d’Ebola antérieures ont été utilisées pour modéliser le changement quotidien dans l’état des patients entre les stades de la maladie. Par exemple, une distribution reposant sur des probabilités en vue de caractériser la probabilité d’une durée d’incubation pendant un nombre de jours donné a été établie à l’aide de données publiées antérieurement (4). La distribution qui en résulte a une période d’incubation moyenne d’environ 6 jours et un percentile de 99, pour 21 jours (Annexe [Figure 4]). D’après des études antérieures, les patients étaient supposés être infectieux pendant une période de 6 jours (3,5).
Les patients ont été répartis en trois catégories : 1) hospitalisés dans une unité de traitement pour Ebola (Ebola treatment unit, ETU) ou un établissement de soins médicaux, 2) à domicile ou dans un cadre communautaire apte à réduire le risque de transmission de la maladie (notamment par l’inhumation sécurisée le cas échéant), et 3) à domicile sans isolement effectif (Annexe [Figure 5]). Hospitalisé fait référence aux établissements tels que les ETU où des soins médicaux sont administrés. Dans l’idéal, de tels établissements suivent des protocoles de contrôle des infections qui doivent prévenir la transmission supplémentaire de la maladie. Cependant, ceci n’est pas toujours le cas. Par conséquent, le risque de transmission quotidien moyen est supérieur à zéro dans ces établissements (c’est-à-dire que la transmission survient), mais le risque est inférieur au rapport d’une personne infectée par patient infectieux (Annexe [Tableau 1]).
Le risque de transmission continue de la maladie par catégorie de patient a été calculé (Annexe [Tableau 1]). La possibilité d’ajouter des cas importés (chiffres entiers) tous les 10 jours (environ la somme de la moyenne de la période d’incubation et de la période infectieuse) a été intégrée à l’outil de modélisation EbolaResponse (Annexe [Tableau 2]). Les cas importés représentent soit des cas de voyageurs qui se déplacent sans détection dans la communauté en provenance d’une zone affectée par la flambée, soit des personnes pouvant représenter des maillons antérieurement non détectés de la chaîne de transmission. Pour estimer le nombre quotidien de lits utilisés (c’est-à-dire des lits dans les établissements de soins médicaux tels que les ETU), on a adapté des données publiées antérieurement pour obtenir la probabilité qu’un patient se rende dans une ETU et le nombre de jours qu’un patient passerait à l’hôpital dans chaque catégorie (6) (Annexe [Tableau 3]).
Une sous-estimation substantielle du nombre de cas rapportés pourrait se produire tant au Liberia qu’en Sierra Leone (7). Pour corriger cette erreur de sous-estimation, on a utilisé EbolaResponse afin de prévoir le nombre de lits occupés le 28 août 2014. Ce nombre a ensuite été comparé au nombre réel de lits occupés (fourni par des estimations effectuées par des spécialistes). La différence entre les deux estimations est le facteur de correction de la sous-estimation possible du nombre de cas rapportés, établi à 2,5 (Annexe [Tableau 4]). L’exactitude des estimations calculées par EbolaResponse a été évaluée en comparant le nombre de cas prédits par le modèle, au nombre de cas rapportés (Annexe [Figure 6, Tableau 5]). La différence entre les estimations calculées à l’aide des données non corrigées et les estimations utilisant les données corrigées pour la sous-estimation reflète la plage d’incertitude possible concernant le nombre de cas réels pouvant survenir.
L’exactitude des prévisions du modèle a été soumise à un test où le nombre des derniers cas rapportés au moment de la rédaction a été comparé au nombre de cas estimés (estimation utilisant des données non corrigées). La dernière date des données rapportées utilisée pour s’adapter au modèle était le 28 août 2014 pour la Sierra Leone, et le 29 août 2014 pour le Liberia. Les cas rapportés ont été comparés aux cas estimés à la date du 9 septembre 2014 pour le Liberia, et du 13 septembre 2014 pour la Sierra Leone.
En l’absence d’intervention préventive universelle (par exemple, un vaccin), le contrôle de l’épidémie consiste à obtenir que le plus grand nombre possible de patients soient traités dans des hôpitaux ou, lorsque les ETU ont atteint le maximum de leur capacité, à domicile ou dans un cadre communautaire apte à réduire le risque de transmission de la maladie (notamment par l’inhumation sécurisée, le cas échéant). Des méthodes adéquates visant à améliorer la protection et à minimiser la transmission de la maladie sont en cours de développement. Afin d’illustrer comment l’augmentation du pourcentage de patients dans ces deux catégories peut contrôler et mettre fin à l’épidémie au Liberia, on a créé le premier scénario. À partir du 24 août 2014 et pendant les 30 jours suivants, le pourcentage de patients hospitalisés dans les ETU avait augmenté de 10 % à 17 % du total des patients. Au cours des 30 jours suivants (à compter du 23 septembre 2014), le pourcentage passe à 25 %, puis reste inchangé pendant le reste de la période couverte par le modèle (Annexe [Figure 7, Figure 8]). À partir du 24 août 2014 et pendant les 30 jours suivants, le pourcentage de patients traités à domicile ou dans un cadre communautaire apte à réduire le risque de transmission de la maladie, grimpe de 8 % à 20 % du total des patients. Des augmentations supplémentaires ont été incluses de sorte qu’au 22 décembre 2014, un total de 70 % des patients figurent dans l’un ou l’autre des deux groupes de patients (25 % dans les ETU et 45 % à domicile ou dans un cadre communautaire apte à réduire le risque de transmission de la maladie) (Annexe [Figure 8]).
Pour illustrer le coût occasionné par l’augmentation tardive des interventions destinées à contrôler et mettre fin à l’épidémie, en termes de cas supplémentaires et de besoin consécutif en ressources supplémentaires pour mettre fin à l’épidémie, un second scénario distinct de contrôle-et-arrêt a été d’abord mis au point comme indiqué ci-après. À partir du 23 septembre 2014 et pendant les 30 jours suivants, le pourcentage de patients hospitalisés dans les ETU augmente de 10 % à 13 %. Ce pourcentage augmente à nouveau pour atteindre 25 % le 23 octobre 2014, puis 40 % le 22 novembre 2014, et finalement 70 % le 22 décembre 2014, (Annexe [Figure 9]) (autrement dit, il faut 90 jours pour que le pourcentage de patients dans les ETU atteigne 70 % du total des patients). Le pourcentage de patients traités à domicile ou dans un cadre communautaire apte à réduire le risque de transmission de la maladie reste stable à 8 %, du 23 septembre 2014 jusqu’à la fin de la période couverte par le modèle. L’effet d’une augmentation tardive des interventions a été alors estimé en répétant deux fois le scénario ci-dessus, mais en fixant la date de départ, soit au 23 octobre 2014, soit au 22 novembre 2014.
Résultats
Si la tendance continue sans interventions supplémentaires, le modèle estime qu’au Liberia et en Sierra Leone le nombre total de cas d’Ebola sera approximativement de 8 000 (21 000 cas au total, après correction pour la sous-estimation du nombre de cas rapportés) au 30 septembre 2014 (Figure 1). Le Liberia comptera environ 6 000 cas (16 000 en corrigeant la sous-estimation du nombre de cas rapportés) (Annexe [Figure 1]). Le total combiné des cas dans les deux pays double environ tous les 20 jours (Figure 1). Les cas rapportés au Liberia doublent tous les 15–20 jours, et ceux rapportés en Sierra Leone doublent tous les 30–40 jours (Annexe [Figure 1]).
Au 30 septembre 2014, en l’absence d’interventions supplémentaires et en utilisant la probabilité indiquée de se rendre dans une ETU, environ 670 lits quotidiennement utilisés (1 700 pour corriger la sous-estimation) seront nécessaires au Liberia et en Sierra Leone (Figure 2). L’extrapolation des tendances au 20 janvier 2015, en l’absence d’interventions supplémentaires ou de changements dans le comportement des communautés (par exemple, la réduction notable des pratiques d’inhumation non sécurisée), le modèle estime également que le Liberia et la Sierra Leone compteront environ 550 000 cas d’Ebola (1,4 million après correction pour la sous-estimation du nombre de cas rapportés) (Annexe [Figure 2]). Les estimations non corrigées pour le Liberia au 9 septembre 2014 étaient de 2 618 cas, alors que le nombre de cas réellement rapportés fait état de 2 407 malades (autrement dit, le modèle a surestimé le nombre de cas de +8,8%). Les estimations non corrigées pour la Sierra Leone au 13 septembre 2014 étaient de 1 505, alors que le nombre de cas réellement rapportés fait état de 1 620 malades (autrement dit, le modèle a sous-estimé le nombre de cas de -7,6%).
Les résultats de l’illustration par les deux scénarios fournissent un exemple de la manière dont l’épidémie peut être contrôlée et finit par être endiguée. Si à la fin décembre 2014, environ 70 % des patients étaient placés soit dans une ETU, soit à domicile ou dans un cadre communautaire apte à réduire le risque de transmission de la maladie (notamment par l’inhumation sécurisée, le cas échéant), l’épidémie dans les deux pays pourrait être presque endiguée au 20 janvier 2015 (Annexe [Figure 3]). Dans le premier scénario, une fois que 70 % des patients sont effectivement isolés, la flambée diminue à un taux presque égal au taux initial de l’augmentation. Le second scénario prévoit un début d’intervention le 23 septembre 2014 de sorte que le pourcentage de tous les patients placés dans une ETU augmente de 10 % à 13 %, puis de manière continue jusqu’à ce que 70 % du total des patients soient placés dans une ETU au plus tard le 22 décembre 2014 ; avec pour conséquence un pic de 1 335 cas quotidiens (3 408 cas estimés en utilisant les données corrigées) et <300 cas quotidiens jusqu’au 20 janvier 2015 (Annexe [Figure 10]). Un début d’intervention retardé au 23 octobre 2014 entraîne un pic de 4 178 cas quotidiens (10 646 cas estimés en utilisant les données corrigées). Un retard encore plus important, jusqu’au 22 novembre, entraîne 10 184 cas quotidiens (25 847 cas estimés en utilisant les données corrigées) au 20 janvier 2015 ; il s’agit de la date la plus lointaine comprise dans le modèle (Annexe [Figure 10]).
Discussion
Le nombre cumulé de cas d’Ebola au Liberia et en Sierra Leone pourrait doubler jusqu’à environ 8 000 à la fin septembre 2014. Cette estimation s’inscrit dans la plage d’autres estimations publiées (8,9). Les cas non rapportés pourraient atteindre un nombre multiplié par un facteur de 2,5, et la fin de l’épidémie exige qu’environ 70 % des personnes infectées par Ebola soient traitées dans une ETU ou à domicile ou dans un cadre communautaire apte à réduire le risque de transmission de la maladie (notamment par l’inhumation sécurisée, le cas échéant). Un coût substantiel peut être associé à l’augmentation tardive des interventions effectives. Dans un scénario pertinent examiné dans ce rapport, chaque retard de 30 jours jusqu’à ce que l’augmentation du pourcentage de patients traités dans les ETU atteigne 70 % du total des patients, a été associé approximativement au triplement du nombre de cas quotidiens survenant au pic de l’épidémie (néanmoins, l’épidémie finit toujours par être endiguée).
Limitations
Les résultats fournis dans ce rapport sont soumis au moins à cinq limitations. En premier lieu, l’extrapolation des tendances actuelles à augmenter le nombre de cas pour prévoir tous les cas futurs pourrait ne pas être adéquate. Des facteurs sous-jacents, tels qu’un changement spontané dans les contacts avec des personnes malades ou dans les pratiques d’inhumation, voire des changements substantiels dans les mouvements de population au sein des pays et à travers les frontières pourraient modifier les modèles de croissance future. Par conséquent, restreindre les projections calculées par le modèle à des durées plus courtes, comme 3 mois, pourrait s’avérer plus pertinent. En second lieu, l’hypothèse selon laquelle cette épidémie a des paramètres épidémiologiques similaires à ceux des flambées antérieures (par exemple, la période d’incubation et la période infectieuse) pourrait ne pas être exacte bien que les preuves anecdotiques n’aient pas indiqué à ce jour qu’il en fût autrement). En troisième lieu, se fier aux avis des spécialistes pour estimer un facteur de correction en ce qui concerne le nombre de lits utilisés ne tient peut-être pas suffisamment compte du fait que des patients voient leur admission rejetée par les ETU dont la pleine capacité est atteinte. Quatrièmement, le facteur de correction pourrait changer substantiellement au fil du temps. Des différences régionales notables dans la sous-estimation du nombre de cas rapportés pourraient signifier qu’il n’est pas adéquat d’utiliser un seul facteur de correction pour l’ensemble du pays. Enfin, le scénario de l’illustration ne tient pas compte des moyens logistiques nécessaires pour augmenter le nombre des patients qui reçoivent des soins dans une ETU, à domicile ou dans un cadre communautaire apte à réduire le risque de transmission de la maladie (notamment par l’inhumation sécurisée, le cas échéant).
Conclusion
Les résultats de ce rapport soulignent les difficultés substantielles pour la santé publique posées par les projections du nombre de cas futurs d’Ebola. Si les conditions se prolongent sans élargissement de l’échelle des interventions, les cas continueront à doubler environ tous les 20 jours, et le nombre de cas en Afrique de l’Ouest atteindra rapidement des niveaux extraordinaires. Toutefois, les résultats indiquent également qu’une épidémie peut être contrôlée. Il est indispensable de s’assurer qu’environ 70 % du total des patients sont traités dans une ETU, ou, quand les ETU ont atteint leur capacité maximale, que les patients sont traités, à domicile ou dans un cadre communautaire apte à réduire le risque de transmission de la maladie (notamment par l’inhumation sécurisée, le cas échéant). La capacité existante des ETU à admettre des patients infectés par Ebola est insuffisante pour endiguer l’augmentation des cas telle qu’estimée. L’augmentation tardive de la capacité des ETU se traduit par un coût exprimé en cas supplémentaires. Les résultats du modèle confirment le besoin d’un plus grand nombre d’ETU qu’il faut construire et équiper en fournitures et en personnel. Les autorités ont mis au point un plan visant à augmenter rapidement la capacité des ETU, et développent actuellement des méthodes innovantes pouvant rapidement élargir l’échelle des isolements de patients dans des cadres non-ETU de sorte à interrompre la transmission d’Ebola dans les communautés. Le gouvernement des États-Unis et des organisations internationales ont récemment annoncé des engagements pour soutenir ces mesures. Alors que ces mesures sont rapidement mises en œuvre et perdurent, les prévisions les plus élevées présentées dans le présent rapport deviennent très improbables.
Remerciements
Les auteurs remercient Karen Wong et Bradford Greening pour leurs commentaires techniques concernant le rapport.
Références
- World Health Organization, Africa Regional Office. Ebola virus disease in Guinea. Geneva, Switzerland: World Health Organization; 2014. Disponible sur le site http://www.afro.who.int/en/clusters-a-programmes/dpc/epidemic-a-pandemic-alert-and-response/outbreak-news/4063-ebola-hemorrhagic-fever-in-guinea.html.
- World Health Organization. Ebola virus disease outbreak—West Africa. Geneva, Switzerland: World Health Organization; 2014. Disponible sur le site http://www.who.int/csr/don/2014_09_04_ebola/en.
- Chowell G, Hengartner NW, Castillo-Chavez C, Fenimore PW, Hyman JM. The basic reproductive number of Ebola and the effects of public health measures: the cases of Congo and Uganda. J Theor Biol 2004;229:119–26.
- Legrand J, Grais RF, Boelle PY, Valleron AJ, Flahault A. Understanding the dynamics of Ebola epidemics. Epidemiol Infect 2007;135:610–21.
- Lekone PE, Finkenstädt BF. Statistical inference in a stochastic epidemic SEIR model with control intervention: Ebola as a case study. Biometrics 2006;62:1170–7.
- Borchert M, Mutyaba I, Van Kerkhove MD, et al. Ebola haemorrhagic fever outbreak in Masindi District, Uganda: outbreak description and lessons learned. BMC Infect Dis 2011;11:357.
- World Health Organization. No early end to the Ebola outbreak. Geneva, Switzerland: World Health Organization; 2014. Disponible sur le site http://www.who.int/csr/disease/ebola/overview-20140814/en.
- Shaman J. Columbia prediction of infectious diseases: Ebola forecasts. New York, NY: Columbia Mailman School of Public Health; 2014. Disponible au site http://cpid.iri.columbia.edu/ebola.html.
- Kupferschmidt K. Disease modelers project a rapidly rising toll from Ebola. ScienceInsider 2014;345 #6200. Disponible sur le site http://news.sciencemag.org/health/2014/08/disease-modelers-project-rapidly-rising-toll-ebola.
* Les dernières mises à jour, notamment le nombre de cas, sur la flambée de la maladie à virus Ebola en 2014, en Afrique de l’Ouest, sont disponibles sur le site http://www.cdc.gov/vhf/ebola/outbreaks/guinea/index.html.
† Le guide clinique le plus actualisé au sujet de la flambée de la maladie à virus Ebola en 2014, en Afrique de l’Ouest, est disponible sur le site http://www.cdc.gov/vhf/ebola/hcp/index.html.
FIGURE 1. Estimation du nombre de cas d’Ebola, avec et sans correction pour la sous-estimation du nombre de cas rapportés,* jusqu’au 30 septembre — Outil de modélisation EbolaResponse, combinaison Liberia et Sierra Leone, 2014
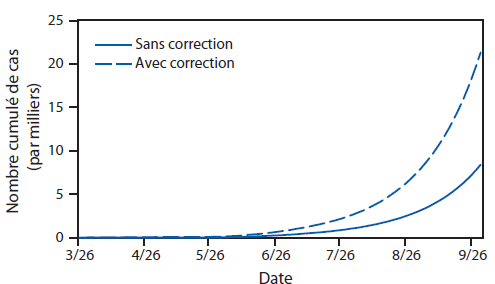
* Correction de la sous-estimation possible du nombre de cas rapportés, en multipliant par un facteur de 2,5 (Annexe [Tableau 4]).
Texte alternatif : La figure ci-dessus illustre l’estimation du nombre de cas d’Ebola au Liberia et en Sierra Leone en 2014, avec ou sans correction pour la sous-estimation du nombre de cas rapportés, selon l’outil de modélisation EbolaResponse. Si la tendance continue sans interventions supplémentaires, le CDC estime qu’au Liberia et en Sierra Leone le nombre total de cas d’Ebola atteindra approximativement 8 000 (21 000 cas, après correction pour la sous-estimation du nombre de cas rapportés) au 30 septembre 2014.
FIGURE 2. Estimation du nombre quotidien de lits utilisés,* avec et sans correction pour la sous-estimation du nombre de cas rapportés,† jusqu’au 30 septembre —Outil de modélisation EbolaResponse, combinaison Liberia et Sierra Leone, 2014
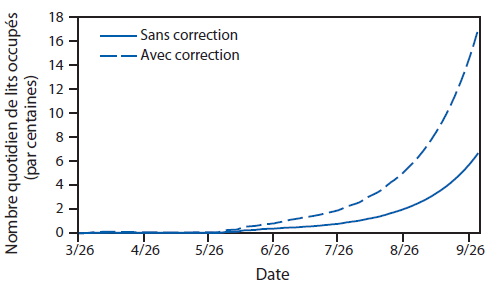
* L’estimation du nombre quotidien de lits utilisés est calculée en utilisant les probabilités de se rendre dans une Unité de traitement d’Ebola (ETU), et du nombre de jours passés dans l’ETU (Annexe [Tableau 3]).
* † Correction de la sous-estimation possible du nombre de cas rapportés, en multipliant par un facteur de 2,5 (Annexe [Tableau 4]).
Texte alternatif : La figure ci-dessus illustre l’estimation du nombre quotidien de lits utilisés au Liberia et en Sierra Leone en 2014, avec ou sans correction pour la sous-estimation du nombre de cas rapportés, selon l’outil de modélisation EbolaResponse. Au 30 septembre 2014, en l’absence d’interventions supplémentaires et en utilisant la probabilité indiquée de se rendre dans une Unité de traitement d’Ebola, environ 670 lits quotidiennement utilisés (1 700 pour corriger la sous-estimation) seront nécessaires au Liberia et en Sierra Leone.
Appendix: Additional Results and Technical Notes for the EbolaResponse Modeling Tool
Additional Results
Numbers of Ebola virus disease cases (hereafter referred to as Ebola) and daily number of beds in use in Liberia and Sierra Leone alone (Figure 1) and in Liberia and Sierra Leone combined (Figure 2) were estimated using the EbolaResponse modeling tool. The outcome of potential interventions on number of cases and beds in use in the two countries combined was simulated (Figure 3).
EbolaResponse Model Overview
CDC has created a spreadsheet-based modeling tool called EbolaResponse that allows users to estimate the number of Ebola cases in a community (Available at http://dx.doi.org/10.15620/cdc.24900). The model tracks patients through the following states: susceptible, infected, incubating, infectious, and recovered (an SIIR model). EbolaResponse is, in effect, a Markov chain model and is similar to an Ebola model built in 2004 (1).
Probabilities drawn from reports of previous Ebola outbreaks are used to model the daily change in patients' status between and within the SIIR states. For example, to estimate the duration of the incubating state, data were adapted from a previous study (2) that indicate the likelihood that an incubation period will last a certain number of days, up to a maximum of 25. A patient can only progress forward through the states and can never regress (e.g., go from the incubating state back to susceptible) or skip a state (e.g., go from the incubating to the recovered state, skipping the infectious state). All infected persons were assumed to eventually become symptomatic. That is, the state of being infected but not becoming symptomatic at any period was not considered.
Assumed Population Size and Numbers Initially Infected
Community sizes equal to the populations of either Liberia or Sierra Leone were assumed and used. The community size can be readily altered. Numbers used in the model as initially infected were chosen to match the number of cases first recorded (2).
Liberia
- Population: 4,294,000 (3)
- Initially infected: Nine
Sierra Leone
- Population: 6,092,000 (3)
- Initially infected: 30
Incubation State
Data from two sources (2,4) were used to construct a lognormal probability distribution of being in the incubation state (Figure 4, Table 1). The mean incubation period derived from this calculation is 6.3 days (standard deviation [SD]: 3.31 days), with a median of 5.5 days and a 99th percentile at 21 days.
In one study, data from a 1995 outbreak in the Democratic Republic of the Congo (DRC, formerly Zaire) and a 2000 outbreak in Uganda were used to estimate mean incubation periods of 5.30 days (SD: 0.23 days) and 3.35 days (SD: 0.49 days), respectively (1). These are lower than other published estimates (2,4). Some of the differences might be attributable to different subtypes of the virus (4).
The incubation distribution can be changed, with an upper limit of 25 days of incubation. Users of the EbolaResponse modeling tool can change the incubation distribution by selecting from two alternative, preprogrammed distributions available from the drop-down menu in the appropriate page in EbolaResponse. The two alternative distributions were based on previously published studies (2,4). As yet another alternative, users can enter their own distribution.
Infectious State
Average Number of Days
An average infectious state of 6 days was assumed in the model, which includes any time taken for a traditional burial. In comparison, data from a 1995 outbreak in DRC and a 2000 outbreak in Uganda (the latter caused by the Sudan strain of Ebola) (5) were used to calculate estimated mean infectious periods of 5.6 and 3.50 days, respectively (1). Data from the 1995 Ebola outbreak in the Congo also were used to calculate an estimated mean infectious period of approximately 6 days (6). Repeated testing of patients with Ebola has demonstrated that the amount of virus present increases until death or approximately 6–10 days after initial infection (7). The EbolaResponse modeling tool can be used to adjust this period from 1 day to a maximum of 15 days.
The risk for onward transmission of infection to a person in the susceptible state was assumed to be equal throughout the 6 days. No data were found regarding whether risk for onward transmission changes over the duration of fulminant illness. However, the possibility exists that the risk does change as a patient becomes more ill and requires more care.
Burial Practices
Traditional burial of the body of a person who has died from Ebola could involve contact with body fluids, posing a risk for infection. For example, in northern Uganda, the body is prepared for burial by the paternal aunt (or if no paternal aunt exists, by an older woman on the paternal side of the family). After removing clothes from the body, the woman washes and dresses it. Funeral rituals include all family members washing their hands in a common bowl and touching the face of the deceased person in the open casket, referred to as a love touch. A white cloth is used to wrap the body, and the body is buried (8). Although this burial ritual is an example from Uganda, researchers have mentioned that similar practices occur throughout Africa (9). Because cultural practices regarding burial might vary by region, users might want to change the period of infectiousness in the model.
Population Governor
Although an exposed state is not included in the model, a population governor is included that prevents the model from calculating more cases than the input population. This overestimation is possible if a user of the model assumes that most of the patients remain home with no effective isolation, the patient category that has the highest risk for onward disease transmission (Table 1).
The governor was programmed by reducing the daily estimate of persons newly infected proportionate to the cumulative reduction in the susceptible population as follows:
Factor to reduce estimate of newly infected at
Day t = [Model population – Cumulative total of newly infected up to Day (t-1)] / Model population
This governor reduces, on a daily basis, the estimated number of persons infected, which effectively lowers the risk for transmission (Table 1). In most instances, this governor is unlikely to affect the calculations from large populations. The governor only begins to appreciably reduce estimates when approximately 40%–50% of the population has become infected. The EbolaResponse governor also is programmed so that the minimum value of the calculated factor cannot be less than 0, preventing the possibility of negative cases.
Distribution Over Time of Patients by Patient Category
Patients were categorized by three types of patient. These three categories have different levels of isolation: 1) hospitalized, 2) home or in a community setting such that there is a reduced risk for disease transmission (including safe burial when needed), and 3) home with no effective isolation.
- Hospitalized patients are in facilities such as Ebola treatment units (ETUs) where medical care is provided. Ideally, such facilities have infection-control protocols that prevent additional disease transmission. However, this is not always the case, and health-care workers in medical care facilities have been infected after contact with Ebola patients (10). Therefore, the average daily risk for transmission is greater than zero in these facilities (i.e., transmission occurs), but the risk is fewer than one person infected per infectious patient (Table 1).
- A patient who is at home or in a community setting such that there is a reduced risk for disease transmission (including safe burial when needed) is being attended to with the overall goal of reducing transmission to other members of the household. If the patient dies, safe burial practices are used. Risk is fewer than one person infected per infectious patient (Table 1).
- A patient who is at home with no effective isolation is being attended to at home but with no specific infection-control measures in place. In addition, if the patient dies, no measures are in place to limit transmission. This patient category has the greatest risk for onward transmission (Table 1).
These three categories have varying risk for onward Ebola virus transmission over time (Figure 5). The estimated values were calculated by altering these values with the risk for onward transmission (Table 1) as well as the number of imported cases or cases in patients with no known contacts (Table 2). All of these values were altered until the estimates of cases produced by the model closely matched (i.e., fit) the reported cases to date (see also Goodness of Fit section).
The distribution of patients into the three patient categories influences the overall progress of the epidemic. For example, the more patients who are hospitalized and at home or in a community setting such that there is a reduced risk for disease transmission, the slower the progress of the epidemic because these two categories are calculated to have transmission rates of fewer than one person infected per infectious person (Table 1). A certain proportion of patients who were home or in a community setting such that there is a reduced risk for disease transmission and home with no effective isolation was assumed to eventually become hospitalized in ETUs (Table 3). However, they were assumed to be hospitalized so late in the progression of the disease that the average risk for onward transmission was unchanged.
Risk for Onward Transmission
The risk for onward transmission from an Ebola patient in the infectious state to persons in the susceptible state varies by patient category (Table 1). The estimated values were calculated by altering these values along with the distribution of patients by category of patient (Figure 5) as well as the number of imported cases or cases in patients with no known contacts (Table 2). All of these values were altered until the estimates of cases produced by the model closely matched (i.e., fit) the reported cases to date (see also Goodness of Fit section).
Allowing for Imported Cases or Cases in Persons With No Known Contacts
The ability to add imported cases (whole numbers) every 10 days was built into the EbolaResponse modeling tool. These persons are entered into the model as infected and then go through incubation before becoming infectious. Imported cases represent 1) Ebola cases in persons who travel into the community undetected from another outbreak-affected area or 2) cases in persons whose infection cannot be readily explained by contact tracing (i.e., apparently no known contact with a previously ill patient). The values shown (Table 2) were used to calculate the estimated cases presented in the main report.
The estimated number of imported cases per each 10-day time step were calculated by altering these numbers along with the distribution of patients by category of patient (Figure 5) as well as the risk for onward transmission (Table 1). All of these numbers were altered until the estimates of cases produced by the model closely matched (i.e., fit) the reported cases to date (see also Goodness of Fit section).
Likelihood of Being Hospitalized and Duration of Hospital Stay
To estimate daily hospital admissions and daily number of beds in use, both the likelihood of a patient being hospitalized and the number of days that a patient in each patient category would spend in the hospital had to be assumed (Table 3).
Correcting for Potential Underreporting
Substantial underreporting of cases might be occurring both in Liberia and Sierra Leone (11). To adjust for such a possibility, the calculated daily number of hospital beds in use was compared with expert opinion of number of beds in use. A correction factor of approximately 2.5 was calculated for Liberia (Table 4). Therefore, to obtain an estimate of actual cases, the reported cases are multiplied by 2.5. After a corrected number of cases was calculated, the model was refitted (see Goodness of Fit section).
Goodness of Fit
The following three variables were altered so that the estimates from the model more closely matched (i.e., fit) the actual reported cases:
- Percentage of patients in each of the three patient categories, with percentages changing over time in increments of 30 days (Figure 5)
- Daily risk for transmission of Ebola by patient category (Table 1)
- Addition of imported cases (Table 2)
For both the Sierra Leone and Liberian data, these three numbers were altered until the estimates of cases for either Sierra Leone or Liberia produced by the model fit the reported cases to date (Table 5, Figure 6) (12). Visual inspection was used to validate the fit of the model-predicted cases to the actual reported cases (Figure 6).
Interventions
Controlling the Epidemic
The EbolaResponse modeling tool was used to construct a scenario to illustrate how control and prevention interventions can slow and eventually stop the Ebola epidemic in Liberia. Control is achieved by moving patients who are being attended to at home with no effective isolation to either the hospitalized category or at home or in a community setting such that there is a reduced risk for disease transmission (including safe burial when needed) category (see also Distribution Over Time of Patients by Patient Category). The more patients who are hospitalized or being attended to at home or in a community setting such that there is a reduced risk for disease transmission, the slower the progress of the epidemic because these two categories are calculated to have transmission rates of fewer than one person infected per infectious person (Table 1). The interventions affect the cumulative numbers of cases of Ebola and daily beds in use (Figure 3, Figure 7).
Methods
Applying Interventions and Distribution of Patients into Categories
As described previously, in the EbolaResponse modeling tool, Ebola patients are categorized by three levels that result in different levels of isolation: 1) hospitalized, 2) home or in a community setting such that there is a reduced risk for disease transmission (including safe burial when needed), and 3) home with no effective isolation. These three categories affect the risk for onward Ebola virus transmission; the highest risk for transmission occurs among patients who are in the third category (Table 1). In the absence of a universal preventive intervention (e.g., vaccine), control of the epidemic consists of having as many patients as possible in either the hospitalized category or at home or in a community setting such that there is a reduced risk for disease transmission category.
To illustrate how increasing the percentage of patients in these two categories can control and eventually end the epidemic in Liberia, the following circumstances were assumed. Starting on August 24, 2014 (day 151 in the model), the percentage of patients hospitalized in ETUs was assumed to increase from 10% of all patients to 17%. In the subsequent 30 days (starting September 21, 2014), the percentage was increased to 25% and stayed at that level for the remainder of the simulation (Figure 8). In addition, starting on August 24, 2014, the percentage of patients at home or in a community setting such that there is a reduced risk for disease transmission (including safe burial when needed) was increased from 8% of all patients to 20%. This percentage was increased to 30% for the following 30 days (starting September 21, 2014). This percentage was then increased to 35% for the 30 days starting October 23, 2015, followed by increases to 40% and 45% on November 22, 2014, and December 22, 2014, respectively (Figure 7).
With the described increases of patients, by December 22, 2014, a total of 70% of patients (25% hospitalized in ETUs and 45% at home or in a community setting such that there is a reduced risk for disease transmission) are estimated to be in the two categories that are known to reduce Ebola transmission.
Fitting the Model and Goodness of Fit
As described previously, to estimate the potential impact of interventions, the input values of the distribution of patients, the risk for onward transmission, and the number of imported cases or cases with no known contacts were altered in the EbolaResponse modeling tool. The interventions are assumed to start after the date of the last reported case. Therefore, the input values for imported cases are the same as those shown for Liberia (both uncorrected and corrected) (Table 2). Similarly, the same values were used for the daily risk for transmission (Table 1). Because the interventions start after the date of the last reported case, the originally calculated input values (Table 1, Table 2, and Table 3) and the resulting goodness of fit for the Liberian data (Table 5 and Figure 6) are all valid for the intervention scenario.
Cost of Delay
To illustrate the cost of delay, in terms of additional cases and the resulting need for additional resources to end the epidemic, in starting to increase interventions that can control and eventually stop the epidemic, a separate control-and-stop scenario was first constructed as follows. Starting on September 23, 2014, and for the next 30 days, the percentage of all patients in ETUs was increased from 10% to 13%. This percentage was again increased on October 23, 2014, to 25%, on November 22, 2014, to 40%, and finally on December 22, 2014, to 70% (Figure 9) (i.e., it takes 90 days for the percentage of patients in ETUs to reach 70% of all patients). The percentage of patients at home or in a community setting such that there is a reduced risk for disease transmission was kept at 8% from September 23, 2014, through the remainder of the period covered by the model. The impact of delay of starting the increase in interventions was then estimated by twice repeating the above scenario but setting the start day on either October 23, 2014, or November 22, 2014.
Starting an intervention on September 23, 2014, such that initially the percentage of all patients in ETUs are increased from 10% to 13% and thereafter including continual increases until 70% of all patients are in an ETU by December 22, 2014, results in a peak of 1,335 daily cases (3,408 cases estimated using corrected data) and <300 daily cases by January 20, 2015 (Figure 10). Delaying the start of the intervention, until October 23, 2014, results in the peak increasing to 4,178 daily cases (10,646 cases estimated using corrected data). Delaying the start further, until November 22, results in 10,184 daily cases (25,847 estimated using corrected data) by January 20, 2015, which is the last date included in the model (Figure 10).
Références
- Chowell G, Hengartner NW, Castillo-Chavez C, Fenimore PW, Hyman JM. The basic reproductive number of Ebola and the effects of public health measures: the cases of Congo and Uganda. J Theor Biol 2004;229:119–26.
- Legrand J, Grais RF, Boelle PY, Valleron AJ, Flahault A. Understanding the dynamics of Ebola epidemics. Epidemiol Infect 2007;135:610–21.
- The World Bank. Data: population, total. Washington, DC: The World Bank; 2014. Disponible sur le site http://data.worldbank.org/indicator/SP.POP.TOTL.
- Eichner M, Dowell SF, Firese N. Incubation period of Ebola hemorrhagic virus subtype Zaire. Osong Public Health Res Perspect 2011;2:3–7.
- CDC. Outbreaks chronology: Ebola hemorrhagic fever. Atlanta, GA: CDC; 2014. Disponible sur le site http://www.cdc.gov/vhf/ebola/resources/outbreak-table.html.
- Lekone PE, Finkenstädt BF. Statistical inference in a stochastic epidemic SEIR model with control intervention: Ebola as a case study. Biometrics 2006;62:1170–7.
- Towner JS, Rollin PE, Bausch DG, et al. Rapid diagnosis of Ebola hemorrhagic fever by reverse-transcription-PCR in an outbreak setting and assessment of patient viral load as a predictor of outcome. J Virol 2004;78:4330–41.
- Hewlett BS, Amola RP. Cultural contexts of Ebola in northern Uganda. Emerg Infect Dis 2003;9:1242–8.
- Bruce JC. Marrying modern health practices and technology with traditional practices: Issues for the African continent. Int Nurs Rev 2002;49:161–7.
- World health Organization. Unprecedented number of medical staff infected with Ebola. Geneva, Switzerland: World Health Organization; 2014. Disponible sur le site http://www.who.int/mediacentre/news/ebola/25-august-2014/en.
- World Health Organization. No early end to the Ebola outbreak. Geneva, Switzerland: World Health Organization; 2014. Disponible sur le site http://www.who.int/csr/disease/ebola/overview-20140814/en.
- World Health Organization. Ebola virus disease outbreak—West Africa. Geneva, Switzerland: World Health Organization; 2014. Disponible sur le site http://www.who.int/csr/don/2014_09_04_ebola/en.
FIGURE 1. Estimation du nombre de cas d’Ebola et du nombre quotidien de lits utilisés,* avec et sans correction pour la sous-estimation du nombre de cas rapportés,† jusqu’au 30 septembre —Outil de modélisation EbolaResponse, combinaison Liberia et Sierra Leone, 2014
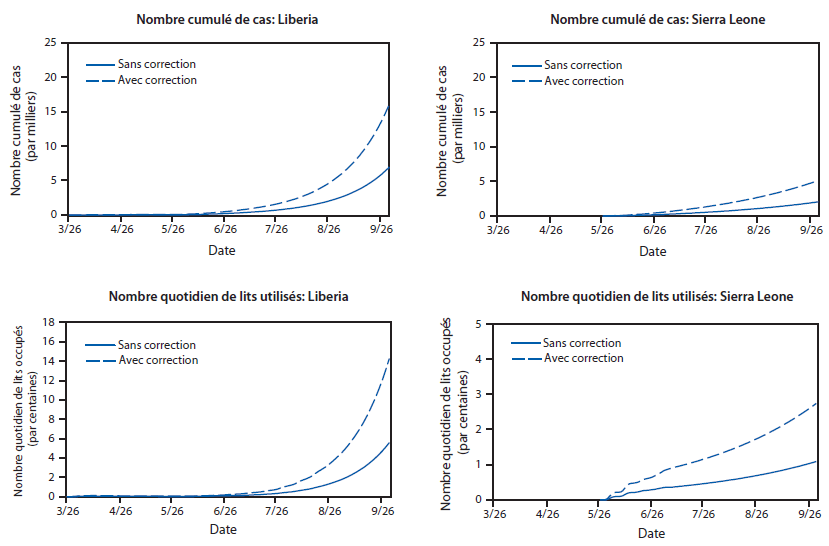
* L’estimation du nombre quotidien de lits utilisés est calculée en utilisant les probabilités de se rendre dans une Unité de traitement d’Ebola (ETU), et du nombre de jours passés dans l’ETU (Tableau 3).
† Correction de la sous-estimation possible du nombre de cas rapportés, en multipliant par un facteur de 2,5 (Tableau 4).
Texte alternatif : La figure ci-dessus illustre l’estimation du nombre de cas d’Ebola et du nombre quotidien de lits utilisés au Liberia et en Sierra Leone en 2014, avec ou sans correction pour la sous-estimation du nombre de cas rapportés, selon l’outil de modélisation EbolaResponse.
FIGURE 2. Estimation du nombre de cas d’Ebola et du nombre quotidien de lits utilisés,* avec et sans correction pour la sous-estimation du nombre de cas rapportés† — Outil de modélisation EbolaResponse, combinaison Liberia et Sierra Leone, 2014–2015
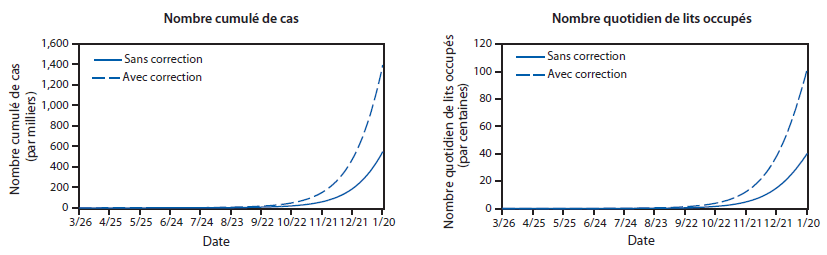
* Correction de la sous-estimation possible du nombre de cas rapportés, en multipliant par un facteur de 2,5 (Tableau 4).
† L’estimation du nombre quotidien de lits utilisés est calculée en utilisant les probabilités de se rendre dans une Unité de traitement d’Ebola (ETU), et du nombre de jours passés dans l’ETU (Tableau 3).
Texte alternatif : La figure ci-dessus illustre l’estimation du nombre de cas d’Ebola et du nombre quotidien de lits utilisés au Liberia et en Sierra Leone en 2014, avec ou sans correction pour la sous-estimation du nombre de cas rapportés, selon l’outil de modélisation EbolaResponse.
FIGURE 3. Estimation de l’effet des interventions* sur le nombre de cas d’Ebola et le nombre quotidien de lits utilisés,† avec et sans correction pour la sous-estimation du nombre de cas rapportés§— Outil de modélisation EbolaResponse, Liberia, 2014–2015
![La figure illustre l’estimation de l’effet des interventions sur le nombre de cas d’Ebola et le nombre quotidien de lits utilisés au Liberia et en Sierra Leone en 2014, avec ou sans correction pour la sous-estimation du nombre de cas rapportés, selon l’outil de modélisation EbolaResponse. L’outil de modélisation EbolaResponse a été utilisé pour créer un scénario illustrant comment [??] les interventions de contrôle et de prévention. Les interventions affectent les nombres cumulés de cas d’Ebola, et le nombre quotidien de lits utilisés.](figures\su6303a1appendixf3_french.gif)
* Pour créer un scénario illustrant le contrôle au Liberia, un scénario de modélisation de l’intervention a été créé dans lequel, à partir du 24 août 2014, le pourcentage de patients dans les Unités de traitement d’Ebola (ETU) passe de 10 % à 17 % du total des patients. Au cours des 30 jours suivants (à compter du 21 septembre 2014), ce chiffre passe à 25 %, puis reste inchangé pendant le reste de la période couverte par le modèle (Figure 8). À partir du 24 août 2014, le pourcentage de patients traités à domicile ou dans un cadre communautaire apte à réduire le risque de transmission de la maladie (notamment par l’inhumation sécurisée, le cas échéant) grimpe de 8 % à 20 % du total des patients. Des augmentations supplémentaires ont été incluses de sorte qu’au 22 décembre 2014, 70 % des patients au total figurent dans l’un ou l’autre des deux groupes de considérés (25 % dans les ETU + 45% à domicile ou dans un cadre communautaire apte à réduire le risque de transmission de la maladie [notamment par l’inhumation sécurisée, le cas échéant]) (Figure 8).
† L’estimation du nombre quotidien de lits utilisés est calculée en utilisant les probabilités de se rendre dans une ETU, et du nombre de jours passés dans l’ETU (Tableau 3).
§ Correction de la sous-estimation possible du nombre de cas rapportés, en multipliant par un facteur de 2,5 (Tableau 4).
Texte alternatif : La figure ci-dessus illustre l’estimation combinée de l’effet des interventions sur le nombre de cas d’Ebola, et le nombre quotidien de lits utilisés au Liberia et en Sierra Leone en 2014, avec ou sans correction pour la sous-estimation du nombre de cas rapportés, selon l’outil de modélisation EbolaResponse. L’outil de modélisation EbolaResponse a été utilisé pour créer un scénario illustrant comment [??] les interventions de contrôle et de prévention. Les interventions affectent les nombres cumulés de cas d’Ebola, et le nombre quotidien de lits utilisés.
FIGURE 4. Distribution de la période d’incubation du virus Ebola, en fonction du nombre de jours d’incubation
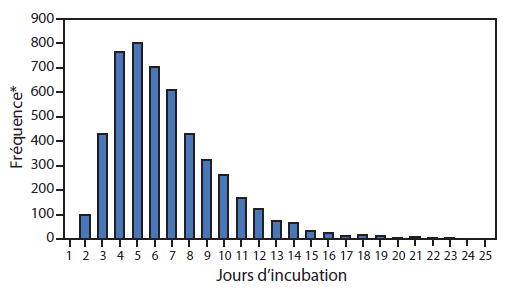
Sources : Données adaptées de Legrand J, Grais RF, Boelle PY, Valleron AJ, Flahault A. Understanding the dynamics of Ebola epidemics. Epidemiol Infect 2007;135:610–21; and Eichner M, Dowell SF, Firese N. Incubation period of Ebola hemorrhagic virus subtype Zaire. Osong Public Health Res Perspect 2011;2:3–7.
* La fréquence se réfère au nombre de patients par rapport à un nombre total de 5 000 patients.
Texte alternatif : La figure ci-dessus illustre la distribution de la période d’incubation du virus Ebola, en fonction du nombre de jours d’incubation. Des données provenant de deux sources ont été utilisées pour construire une distribution logarithmique des probabilités de se trouver en état d’incubation. La période d’incubation moyenne dérivée de ce calcul est de 6,3 jours (écart type : 3,31 jours), avec une médiane de 5,5 jours et un percentile de 99, à 21 jours.
FIGURE 5. Proportion de patients* infectés par le virus Ebola au fil du temps, par catégorie de patient† — Outil de modélisation EbolaResponse, Liberia et Sierra Leone, 2014
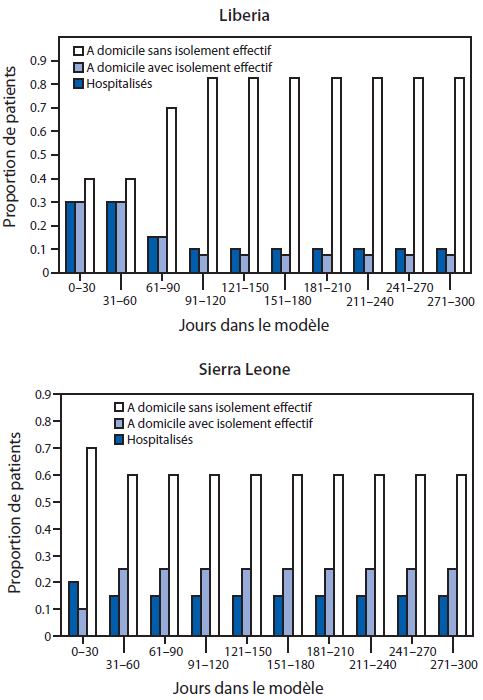
* Estimation de la distribution à l’aide de l’outil de modélisation, obtenue après avoir adapté le résultat du modèle (nombre cumulé de cas) aux données réelles.
† Les patients sont répartis dans l’outil de modélisation EbolaResponse, dans l’une de ces trois catégories : 1) hospitalisés, 2) à domicile ou dans un cadre communautaire apte à réduire le risque de transmission de la maladie (notamment par l’inhumation sécurisée le cas échéant), et 3) à domicile sans isolement effectif. Ces trois catégories reflètent le risque de transmission ultérieure du virus Ebola (Tableau 1). EbolaResponse est programmé pour effectuer des changements dans la distribution des patients parmi les trois catégories de soins, tous les 30 jours. Pour le Liberia, le jour 1 correspond au 3 mars 2014, et pour la Sierra Leone, au 27 mai 2014. Le 22 septembre 2014 correspond au jour 180, lorsque le modèle a été adapté aux données du Liberia, tandis que le modèle a été adapté aux données de la Sierra Leone le jour 119.
Texte alternatif : La figure ci-dessus illustre la proportion de patients infectés par le virus Ebola au fil du temps, par catégorie de patient, au Liberia et en Sierra Leone, en 2014, selon l’outil de modélisation EbolaResponse. Les patients ont été classés dans trois types de catégories. Ces trois catégories comportent des niveaux d’isolement différents : 1) hospitalisés, 2) à domicile ou dans un cadre communautaire apte à réduire le risque de transmission de la maladie (notamment par l’inhumation sécurisée le cas échéant), et 3) à domicile sans isolement effectif. Ces trois catégories sont à risque variable de transmission ultérieure du virus Ebola, au fil du temps. Le pourcentage de patients dans chacune des trois catégories de patient, avec un changement des pourcentages au fil du temps, par incréments de 30 jours, était l’une de trois variables modifiées de telle manière que les estimations fournies par le modèle s’appariaient (c’est-à-dire, correspondaient) plus étroitement au nombre de cas réellement rapportés.
FIGURE 6. Qualité de l’ajustement : comparaison entre le nombre cumulé de cas d’Ebola rapportés et le nombre de cas prévus par le modèle*— Outil de modélisation EbolaResponse, Liberia et Sierra Leone, 2014
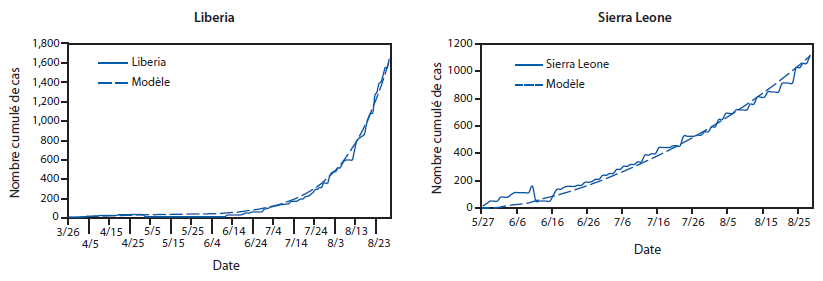
* Nombre de cas prévus par le modèle, obtenu en modifiant le pourcentage de patients dans chacune des trois catégories de patient (Figure 5), risque de transmission du virus Ebola par catégorie de patient (Tableau 1), et ajout de cas importés (Tableau 2) jusqu’à ce que les estimations produites par le modèle pour la Sierra Leone ou le Liberia s’apparient (correspondent) étroitement au nombre de cas rapportés à ce jour, par l’Organisation Mondiale de la Santé.
Texte alternatif : La figure ci-dessus illustre la qualité de l’ajustement : comparaison entre le nombre cumulé de cas d’Ebola rapportés et le nombre de cas prévus par le modèle, au Liberia et en Sierra Leone, en 2014, selon l’outil de modélisation EbolaResponse. Les trois variables suivantes ont été modifiées de sorte que les estimations du modèle s’apparient (correspondent) plus étroitement au nombre de cas réellement rapportés : Pourcentage de patients dans chacune des trois catégories de patient, ce pourcentage variant au fil du temps par incréments de 30 jours. Risque quotidien de transmission du virus Ebola par catégorie de patient. Ajout des cas importés. Tant pour les données de la Sierra Leone que celles du Liberia, ces trois valeurs ont été modifiées jusqu’à ce que les estimations du nombre de cas produites par le modèle au Liberia ou en Sierra Leone correspondent aux cas rapportés à ce jour.
FIGURE 7. Estimation de l’effet des interventions sur le nombre cumulé de cas d’Ebola, avec et sans données corrigées*— Outil de modélisation EbolaResponse, Liberia, 2014
![La figure illustre l’effet estimé des interventions sur le nombre cumulé de cas d’Ebola au Liberia, en 2013, avec et sans données corrigées, selon l’outil de modélisation EbolaResponse. L’outil de modélisation EbolaResponse a été utilisé pour créer un scénario illustrant comment [??] les interventions de contrôle et de prévention. Les interventions affectent les nombres cumulés de cas d’Ebola, et le nombre quotidien de lits utilisés.](figures\su6303a1appendixf7_french.gif)
* Correction de la sous-estimation possible du nombre de cas rapportés, en multipliant par un facteur de 2,5 (Tableau 4).
Texte alternatif : La figure ci-dessus illustre l’effet estimé des interventions sur le nombre cumulé de cas d’Ebola au Liberia, en 2013, avec et sans données corrigées, selon l’outil de modélisation EbolaResponse. L’outil de modélisation EbolaResponse a été utilisé pour créer un scénario illustrant comment [??] les interventions de contrôle et de prévention. Les interventions affectent les nombres cumulés de cas d’Ebola, et le nombre quotidien de lits utilisés.
FIGURE 8. Estimation de l’effet des interventions en changeant la proportion de patients* infectés par le virus Ebola au fil du temps, par catégorie de patient†— Outil de modélisation EbolaResponse, Liberia, 2014
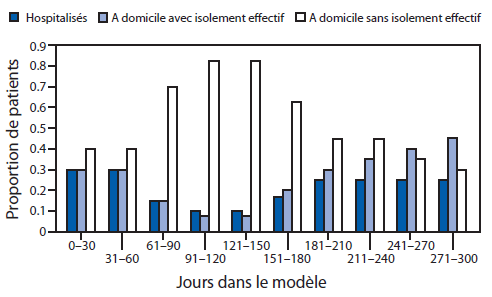
* Estimation de la distribution à l’aide de l’outil de modélisation jusqu’au 24 août 2014 (jour 151), obtenue après avoir adapté le résultat du modèle (nombre cumulé de cas) aux données réelles. Après cette date, les distributions sont basées sur des estimations déterminées à partir du scénario afin d’illustrer comment les interventions peuvent ralentir et finir par endiguer l’épidémie d’Ebola au Liberia.
† Les patients sont répartis dans l’outil de modélisation EbolaResponse, dans l’une de ces trois catégories : 1) hospitalisés, 2) à domicile ou dans un cadre communautaire apte à réduire le risque de transmission de la maladie (notamment par l’inhumation sécurisée le cas échéant), et 3) à domicile sans isolement effectif. Ces trois catégories reflètent le risque de transmission ultérieure du virus Ebola (Tableau 1). EbolaResponse est programmé pour effectuer des changements dans la distribution des patients parmi les trois catégories, tous les 30 jours. Pour le Liberia, le jour 1 correspond au 3 mars 2014, et le 22 septembre 2014 correspond au jour 180.
Texte alternatif : La figure ci-dessus illustre l’estimation de l’effet des interventions sur la proportion de patients infectés par le virus Ebola au fil du temps, par catégorie de patient, au Liberia en 2014, selon l’outil de modélisation EbolaResponse. Afin d’illustrer comment l’augmentation du pourcentage de patients dans ces deux catégories peut contrôler et mettre fin à l’épidémie au Liberia, on a présumé les circonstances suivantes. Dès le commencement le 24 août 2014 (jour 151 dans le modèle), le pourcentage de patients hospitalisés dans les Unités de traitement d’Ebola est supposé passer de 10 % à 17 % du total des patients. Au cours des 30 jours suivants (à compter du 21 septembre 2014), ce pourcentage atteint 25 %, puis reste inchangé pendant le reste de la simulation.
FIGURE 9. Estimation de l’effet du retard des interventions* en modifiant la proportion de patients infectés par le virus Ebola au fil du temps, par catégorie de patient†— Outil de modélisation EbolaResponse, Liberia, 2014
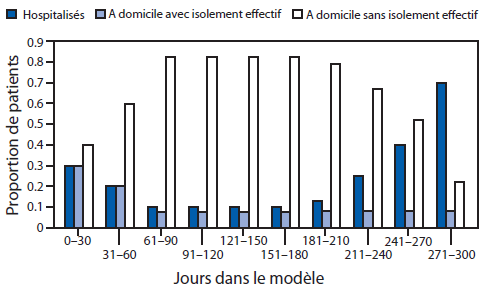
* Intervention : À partir du 23 septembre 2014 (jour 181 dans le modèle) et pendant les 30 jours suivants, le pourcentage de tous les patients hospitalisés dans une Unité de traitement d’Ebola (ETU) passe de 10 % à 13 %. Ce pourcentage augmente encore atteignant 25 % le 23 octobre 2014 (jour 211 dans le modèle), puis 40 % le 22 novembre 2014 (jour 241 dans le modèle), et enfin 70 % le 22 décembre 2014 (jour 271 dans le modèle). Le jour 1 dans le modèle correspond au 3 mars 2014. L’effet d’une augmentation tardive des interventions a été ensuite estimé en répétant deux fois le scénario ci-dessus, mais en fixant la date de départ, soit au 23 octobre 2014, soit au 22 novembre 2014.
† Les patients sont répartis dans l’outil de modélisation EbolaResponse, dans l’une de ces trois catégories : 1) hospitalisés, 2) à domicile ou dans un cadre communautaire apte à réduire le risque de transmission de la maladie (notamment par l’inhumation sécurisée le cas échéant), et 3) à domicile sans isolement effectif. Ces trois catégories reflètent le risque de transmission ultérieure du virus Ebola (Tableau 1).
Texte alternatif : La figure ci-dessus illustre l’effet estimé du retard des interventions sur la proportion de patients infectés par le virus Ebola au fil du temps, par catégorie de patient, au Liberia, en 2014, selon l’outil de modélisation EbolaResponse. Afin d’illustrer comment l’augmentation du pourcentage de patients dans ces deux catégories peut contrôler et mettre fin à l’épidémie au Liberia, on a présumé les circonstances suivantes. Dès le commencement le 23 septembre 2014 (jour 181 dans le modèle), le pourcentage de patients hospitalisés dans les Unités de traitement d’Ebola est supposé passer de 10 % à 17 % du total des patients. Ce pourcentage passe à 25 % le 23 octobre 2014 (jour 211 dans le modèle), puis à 40 % le 22 novembre 2014 (jour 241 dans le modèle), pour atteindre 70 % le 22 décembre 2014 (jour 271 dans le modèle).
FIGURE 10. Estimation de l’effet des interventions* sur le nombre de cas d’Ebola, avec et sans correction pour la sous-estimation du nombre de cas rapportés†—Outil de modélisation EbolaResponse, Liberia, 2014–2015
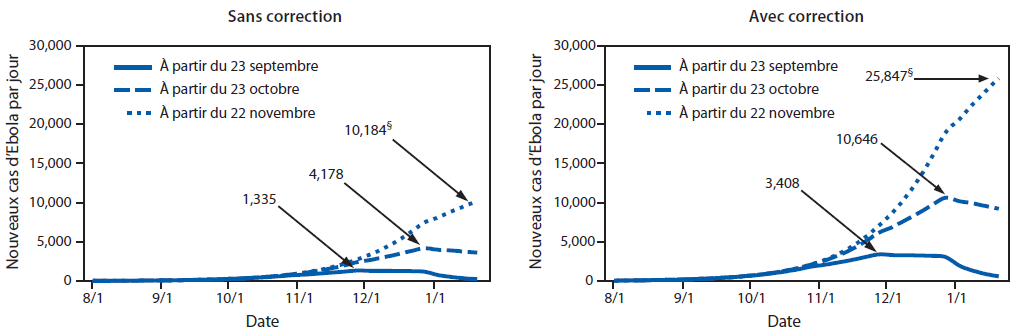
* Intervention : À partir du 23 septembre 2014 (jour 181 dans le modèle) et pendant les 30 jours suivants, le pourcentage de tous les patients hospitalisés dans une Unité de traitement d’Ebola (ETU) passe de 10 % à 13 %. Ce pourcentage augmente encore atteignant 25 % le 23 octobre 2014 (jour 211 dans le modèle), puis 40 % le 22 novembre 2014 (jour 241 dans le modèle), et enfin 70 % le 22 décembre 2014 (jour 271 dans le modèle). Le jour 1 dans le modèle correspond au 3 mars 2014. L’effet d’une augmentation tardive des interventions a été ensuite estimé en répétant deux fois le scénario ci-dessus, mais en fixant la date de départ, soit au 23 octobre 2014, soit au 22 novembre 2014.
† Correction de la sous-estimation possible du nombre de cas rapportés, en multipliant par un facteur de 2,5 (Tableau 4).
§ Nouveaux patients infectés par le virus Ebola au pic de chaque date de commencement. (À noter que lorsqu’une intervention débute le 22 novembre 2014, le pic n’est pas atteint avant le 20 janvier 2014, qui est la dernière date incluse dans le modèle.)
Texte alternatif : La figure ci-dessus illustre l’effet estimé du retard des interventions sur le nombre quotidien de cas d’Ebola, au fil du temps, au Liberia, en 2014, avec ou sans correction pour la sous-estimation du nombre de cas rapportés, selon l’outil de modélisation EbolaResponse. Dès le commencement le 23 septembre 2014 (jour 181 dans le modèle), le pourcentage de patients hospitalisés dans les Unités de traitement d’Ebola est supposé passer de 10 % à 17 % du total des patients. Ce pourcentage passe à 25 % le 23 octobre 2014 (jour 211 dans le modèle), puis à 40 % le 22 novembre 2014 (jour 241 dans le modèle), pour atteindre 70 % le 22 décembre 2014 (jour 271 dans le modèle).
L’usage de marques de commerce et de sources commerciales a uniquement un but d’identification et n’implique aucune recommandation de la part du Département de la santé et des services humains des États-Unis.
Les références à des sites Internet non-CDC sont fournies comme service aux lecteurs du MMWR et ne constituent ni n’impliquent aucune recommandation pour ces organisations ou leurs programmes, de la part du CDC ou du Département de la santé et des services humains des États-Unis. Le CDC n’est aucunement responsable du contenu des pages consulté sur ces sites. Les adresses URL indiquées dans le MMWR étaient à jour à la date de publication.
Toutes les versions HTML des articles du MMWR sont des conversions électroniques de documents typographiés. Il est possible que cette conversion entraîne des erreurs dans la traduction des caractères ou de format dans la version HTML. Les utilisateurs sont renvoyés à la version PDF électronique (http://www.cdc.gov/mmwr) et/ou à la copie papier originale du MMWR pour accéder aux versions imprimables de texte, figures et tableaux officiels. Il est possible de se procurer un exemplaire papier original de ce numéro auprès du Superintendent of Documents, U.S. Government Printing Office (GPO), Washington, DC 20402-9371 ; téléphone : (202) 512-1800. S’adresser au GPO pour obtenir les prix courants.
**Les questions ou messages concernant les erreurs de formatage doivent être adressés à mmwrq@cdc.gov.


