FIGURA 1. Proceso de evaluación de riesgos para peligros biológicos
Persons using assistive technology might not be able to fully access information in this file. For assistance, please send e-mail to: mmwrq@cdc.gov. Type 508 Accommodation and the title of the report in the subject line of e-mail.
Pautas para prácticas laborales seguras en laboratorios de diagnóstico médico para humanos y animales
Recomendaciones de un panel de especialistas en bioseguridad (Biosafety Blue Ribbon Panel) convocado por los CDC
Tenga en cuenta que: Se ha publicado una errata para este artículo. Si desea ver la errata, haga clic aquí.
El material de este informe se originó en el Centro Nacional de Enfermedades Infecciosas Emergentes y Zoonóticas (National Center for Emerging and Zoonotic Infectious Diseases), Beth P. Bell, MD, MPH, Director.
Responsable de correspondencia: Michael Miller, PhD, Microbiology Technical Services, LLC, Dunwoody, GA 30338. Teléfono: 678-428-6319; Fax: 770-396-0955; Correo electrónico: jmm8@comcast.net.
Resumen
La prevención de las lesiones e infecciones ocupacionales es un asunto que ha interesado a los laboratorios de EE. UU. durante muchos años. Los Centros para el Control y la Prevención de Enfermedades (Centers for Disease Control and Prevention, CDC) y los Institutos Nacionales de Salud (National Institutes of Health) abordaron el tema en su publicación Bioseguridad en laboratorios microbiológicos y biomédicos (Biosafety in Microbiological and Biomedical Laboratories), que actualmente está en su 5.ª edición (BMBL-5). No obstante, el objetivo de BMBL-5 no era abordar las operaciones cotidianas de los laboratorios de diagnóstico en medicina humana y animal. En 2008, los CDC convocaron a un panel de especialistas (Blue Ribbon Panel) integrado por representantes de laboratorios de diversos organismos, organizaciones de laboratorios y centros para revisar la bioseguridad del laboratorio en los laboratorios de diagnóstico. Los integrantes de este panel recomendaron que se elaboraran pautas de bioseguridad para abordar las necesidades operativas específicas de la comunidad de los laboratorios de diagnóstico, y que estas tuvieran una base científica y se difundieran ampliamente. Estas pautas promueven una cultura de seguridad e incluyen recomendaciones que complementan la publicación BMBL-5, al abordar las necesidades específicas del laboratorio de diagnóstico. No son requisitos, sino recomendaciones que representan el conocimiento científico actual y el buen juicio que pueden fomentar un ambiente de trabajo seguro para todo el personal de laboratorios.
A lo largo de todas las pautas, la ciencia de laboratorio de calidad se ha reforzado con un enfoque basado en el sentido común con respecto a la bioseguridad en las actividades cotidianas. Debido a que se utilizan muchas de las mismas técnicas de diagnóstico en laboratorios de diagnóstico en humanos y animales, el texto se presenta tomando esto en cuenta. Se abordan todas las funciones de los laboratorios de diagnóstico para humanos y animales: microbiología, química, hematología y patología con orientación para autopsia y necropsia. En una sección específica sobre laboratorios de diagnóstico veterinario, se abordan las cuestiones veterinarias no compartidas con otros departamentos de laboratorio para humanos. Las recomendaciones para todos los laboratorios incluyen el uso de gabinetes de seguridad biológica clase IIA2 que se inspeccionan anualmente; lavado frecuente de las manos; uso adecuado de desinfectantes, incluidas diluciones 1:10 de lejía doméstica; dependencia de evaluaciones del riesgo para muchas actividades; elaboración de protocolos de seguridad por escrito que traten los riesgos de las sustancias químicas en el laboratorio; la necesidad de flujo de aire negativo en el laboratorio; áreas del laboratorio en las que el uso de guantes sea opcional o esté recomendado; y la necesidad a nivel nacional de contar con un sitio central de vigilancia e informes no punitivos de incidentes/exposiciones, lesiones e infecciones en el laboratorio.
1. Introducción: Una cultura de seguridad para los laboratorios de diagnóstico
Este informe ofrece orientación y recomienda prácticas de bioseguridad específicamente para laboratorios de diagnóstico clínico para humanos y animales, y está diseñado como un suplemento de la 5.ª edición de Bioseguridad en laboratorios microbiológicos y biomédicos (BMBL-5), publicación preparada por los CDC y los Institutos Nacionales de Salud (1). Este documento no fue escrito para reemplazar las pautas de bioseguridad existentes, sino para 1) mejorar la seguridad de las actividades realizadas en laboratorios de diagnóstico clínico, 2) alentar a los trabajadores de los laboratorios a pensar en cuestiones de seguridad que tal vez no hayan considerado o abordado anteriormente y 3) alentar al personal de laboratorios a crear y fomentar una cultura de seguridad en los mismos. Si alguna de las pautas incluidas en este documento entrara en conflicto con las leyes o los requisitos reglamentarios federales, estatales o locales, el personal de laboratorio se debe referir a los requisitos federales, estatales o locales. Esta cultura de seguridad también está respaldada por el Instituto de Estándares Clínicos y de Laboratorio (Clinical and Laboratory Standards Institute) (2). El trabajo en un laboratorio de diagnóstico supone consideraciones de seguridad que van más allá del componente biológico; por lo tanto, estas pautas también abordan algunas de las cuestiones de seguridad cotidianas más importantes que afectan al personal de laboratorio en entornos en los que la seguridad biológica es un punto central de interés.
Según la Oficina de Estadísticas Laborales de EE. UU. (U.S. Bureau of Labor Statistics), en 2008, alrededor de 328.000 técnicos y científicos de laboratorios médicos trabajaban en laboratorios de diagnóstico para humanos en Estados Unidos. Se calcula que 500.000 personas de todas las profesiones trabajan en laboratorios de diagnóstico para seres humanos y animales. Cualquiera de esos trabajadores que tenga una afección médica crónica o que reciba terapia inmunosupresora tendría un mayor riesgo de contraer una infección adquirida en el laboratorio (laboratory-acquired infection, LAI) después de una exposición en el laboratorio. El riesgo preciso después de una exposición se desconoce porque a menudo es difícil determinar la fuente o el modo de transmisión. No existe ningún sistema de vigilancia a nivel nacional.
Los informes de LAI y exposiciones existen desde principios del siglo XX, pero solo hasta la década de 1970 se contó con datos suficientes para intentar hacer una evaluación cuantitativa del riesgo. Informes recientes de MMWR (3–11) indican que las bacterias representan > 40 % de las infecciones, con > 37 especies informadas como agentes etiológicos en las LAI; sin embargo, podría haber otros microbios implicados. La hepatitis B es la infección viral adquirida en el laboratorio más frecuente, con una tasa de 3,5 a 4,6 casos por cada 1000 trabajadores, lo que implica entre 2 y 4 veces más que la tasa de la población general. Cualquier empleado de laboratorio que recoja o manipule tubos de sangre es vulnerable (12).
En encuestas anteriores sobre LAI, se halló que el personal de laboratorio tenía entre tres y nueves veces más probabilidades que la población general de contraer una infección por Mycobacterium tuberculosis (13,14). En una encuesta de 1986 realizada en alrededor de 4000 trabajadores de 54 laboratorios de salud pública y 165 laboratorios hospitalarios en Estados Unidos, 3,5/1000 infecciones de empleados se produjeron en laboratorios hospitalarios y 1,4/1000 infecciones de empleados se produjeron en laboratorios de salud pública (15). En una encuesta de 1994–1995 realizada en 25.000 empleados de laboratorio de 397 laboratorios clínicos en el Reino Unido, la tasa general de LAI fue de 18/100.000 empleados (16).
En un estudio de 2005 realizado por los CDC sobre meningitis bacteriana entre el personal de laboratorios de EE. UU., la infección por Neisseria meningitidis representó una cantidad considerable de LAI. La tasa de ataque de este organismo en la población general era de 13/100.000 personas. La tasa de ataque en la población general de 30 a 59 años de edad (el rango de edad estimado del personal de laboratorio promedio) fue de 0,3 por cada 100.000. La tasa de ataque en microbiólogos (de 30 a 59 años de edad) fue de 20/100.000 (17).
Las LAI también incluyen infecciones micóticas y parasitarias. Los agentes más comunes de infecciones micóticas adquiridas en el laboratorio son los hongos dimórficos Blastomyces, Histoplasma y Coccidioides (18,19); la mayoría de las infecciones informadas fueron provocadas por inhalación de conidios. Las LAI informadas asociadas con parásitos fueron provocadas principalmente por Leishmania, Plasmodium, Toxoplasma, el organismo de la enfermedad de Chagas y otros tripanosomas (20). De los 52 casos de malaria adquirida en el laboratorio, 56 % fueron transmitidos por vector (por mosquitos usados en investigación, no en laboratorios clínicos). La mayoría de los trabajadores de la atención de la salud infectados adquirieron la infección al pincharse con una aguja durante la preparación de frotis de sangre o al extraer sangre.
En los laboratorios de química clínica, datos de 17 hospitales de Nueva York enumeraron la punción con aguja (103 casos), derrames de ácido o álcali (46), cortaduras con vidrio (44), salpicadura en el ojo (19) y hematomas y cortes (45) como las exposiciones más frecuentes (21). La punción con aguja, las cortaduras con vidrio, las salpicaduras en los ojos y los hematomas y cortes tienen el mayor potencial de infección por microbios.
En el laboratorio de hematología, las principales causas de lesiones son probablemente la exposición a la sangre y fluidos corporales, las punciones con aguja, aerosoles de centrífugas o el retiro de tapones de tubos, la rotura de tubos o los guantes contaminados (22). En las secciones del laboratorio de diagnóstico que no son de microbiología, el principal error puede ser suponer que una muestra determinada no contiene agentes infecciosos y trabajar entonces prestando poca atención al riesgo de infección. Esta situación puede ser especialmente problemática en laboratorios en los que se desarrollan nuevas tecnologías, como tecnología molecular o bioquímica, y en diagnósticos en el lugar realizados por personal que no está acostumbrado a hacer análisis que requieren consideraciones de bioseguridad y el uso de técnicas de barrera, como equipo de protección personal.
1.1. Métodos
Los riesgos y causas de las LAI se han documentado. Sin embargo, son escasas las publicaciones y las investigaciones basadas en la evidencia que se centran en la bioseguridad; en particular, faltan estudios que documenten prácticas seguras en las operaciones cotidianas de los laboratorios de diagnóstico.
En 2008, los CDC convocaron a un panel de especialistas (Blue Ribbon Panel) integrado por representantes de laboratorios de diversos organismos, organizaciones de laboratorios y centros para revisar la bioseguridad del laboratorio en los laboratorios de diagnóstico. Los integrantes del panel fueron seleccionados por la organización nacional de laboratorios invitada que representaban o fueron invitados por los CDC debido a sus funciones en materia de bioseguridad a nivel nacional. Las organizaciones que participaron en el panel representaban a la mayoría de los tecnólogos de laboratorios de Estados Unidos. Además, algunos integrantes del panel eran representantes de la comunidad de bioseguridad. Los integrantes del panel recomendaron que se elaboraran pautas de bioseguridad para abordar las necesidades operativas específicas de la comunidad de los laboratorios de diagnóstico, y que estas tuvieran una base científica y se difundieran ampliamente.
Los integrantes del panel revisaron las pautas elaboradas y el equipo de redacción las resumió. No fue necesario contar con el aval oficial de las organizaciones que representaban, aunque cada representante debía presentar la aprobación por escrito de las recomendaciones. Las correcciones y comentarios de cada participante se consideraron atentamente y se incorporaron donde fuera pertinente. Las pautas incluidas en el presente documento se resumieron y respaldaron a partir de revisiones sistemáticas de publicaciones con revisión de expertos de datos basados en evidencias, a partir de los cuales fue posible elaborar las recomendaciones, justificando los enfoques basados en el sentido común que se deben articular y casos en los que se han descrito y demostrado procedimientos de seguridad. Debido a la falta de investigación basada en la evidencia en mucha de la bibliografía actual sobre prácticas de bioseguridad, no se ha intentado sopesar la evidencia y las recomendaciones resultantes (es decir, sólidas o débiles). En ausencia de documentación e investigaciones basadas en evidencias que las respalden, algunas recomendaciones se basan en la opinión experta de especialistas internacionales en el campo de la microbiología, y se deben aplicar adecuadamente hasta que la investigación basada en evidencias pueda corroborar su validez. Los autores revisaron y aprobaron sus propias secciones, y también evaluaron qué tan bien reflejan y respaldan sus temas los objetivos de todo el documento.
Cada sección de recomendaciones fue revisada tanto internamente por los CDC como por las organizaciones nacionales pertinentes cuyos integrantes adoptarían estas pautas. Estas organizaciones incluyen: College of American Pathologists, Greater New York Hospital Association Regional Laboratory Task Force, American Society for Microbiology, American Clinical Laboratory Association, Association of Public Health Laboratories, American Society for Clinical Laboratory Science, American Society for Clinical Pathology, American Biological Safety Association, American Association of Veterinary Laboratory Diagnosticians, y médicos y especialistas individuales en la materia. La investigación futura de prácticas de bioseguridad en el laboratorio contribuirá a ampliar las recomendaciones y corroborará otras, además de brindar oportunidades para corregir este documento.
1.2. Riesgo
Las personas que trabajan en laboratorios de diagnóstico clínico están expuestas a muchos riesgos (1). Ya sea que los pacientes sean humanos o animales, e independientemente de si el personal de laboratorio trabaja en microbiología o en otra área del laboratorio, el laboratorio de diagnóstico para humanos y animales es un entorno desafiante. Cuanto más conozcan y sigan las precauciones de seguridad recomendadas basadas en la ciencia los empleados del laboratorio, menor será el riesgo. El objetivo del programa de seguridad es disminuir el riesgo lo más cerca posible de cero, aunque alcanzar un riesgo de cero todavía no es posible, ya que se manipulan muestras de pacientes y organismos vivos. La protección del personal de laboratorio, los compañeros de trabajo, los pacientes, las familias y el medio ambiente es la principal inquietud de seguridad.
1.3. Exposiciones en el laboratorio
Las exposiciones en el laboratorio ocurren con más frecuencia de lo que se sospecha generalmente. Otros incidentes de laboratorio, como raspones o cortes menores, derrames insignificantes o aerosoles no detectados ocurren incluso con más frecuencia y es posible que no ocasionen una exposición que derive en una LAI. En este informe, las “exposiciones en el laboratorio” se refieren a eventos que ponen a los empleados en riesgo de desarrollar una LAI y a eventos que ocasionan la adquisición de hecho de una LAI. Excepto por los requisitos de informe impuestos por el Programa de agentes selectos de los CDC, que se ocupa de la manipulación de agentes biológicos y toxinas específicos y potencialmente peligrosos, no existe ningún sistema de vigilancia a nivel nacional al que se deban informar las exposiciones en un laboratorio médico y el desarrollo posterior de infecciones relacionadas con el trabajo. Desde 2001, la atención se ha enfocado en la bioseguridad y la bioprotección en los laboratorios, pero esta se ha limitado en gran medida a precauciones necesarias para agentes de bioterrorismo. Otras exposiciones en el laboratorio y LAI siguen ocurriendo, casi siempre debido a una violación de los protocolos de seguridad establecidos. Debido a la ausencia de un mecanismo de vigilancia oficial para informar las LAI y al temor de acciones punitivas por parte de un organismo de vigilancia si se informan lesiones, no se cuenta con los datos necesarios para determinar la medida y la causa de las LAI. Además, hay una escasez de información basada en evidencias para la prevención de las LAI.
El panel de especialistas reconoce la necesidad de que se implemente un sistema de vigilancia e informes voluntario y no punitivo en Estados Unidos, con la posibilidad de informar anónimamente. Dicho sistema permitiría informar y evaluar todas las LAI, y posiblemente conduciría a realizar capacitaciones e intervenciones para hacer posible que la tasa de incidencia sea despreciable.
1.4. Vías de las infecciones de laboratorio
Las cinco vías predominantes de las LAI son:
- inoculaciones parenterales con agujas de jeringas u otros objetos cortopunzantes contaminados;
- derrames y salpicaduras en la piel y las membranas mucosas;
- ingestión o exposición a través de la boca mediante pipetas o por tocarse la boca o los ojos con los dedos o con objetos contaminados;
- mordidas y rasguños de animales (laboratorios o actividades de investigación); e
- inhalación de aerosoles infecciosos (1).
Las primeras cuatro vías son relativamente fáciles de detectar, pero representan < 20 % de todas las LAI informadas (23,24). No se identificaron eventos de exposición reconocibles en alrededor del 80 % de las LAI informadas antes de 1978 (24–26). En muchos casos, la única asociación fue que la persona infectada trabajaba con un agente microbiológico o cerca de una persona que manipulaba un agente microbiológico. La incapacidad de identificar un evento específico también se informó en un estudio más reciente (27), en el que se halló que las fuentes probables de las LAI solo eran evidentes en el 50 % de los casos. Esos datos sugieren que los aerosoles infecciosos de los que no se sospecha pueden tener un papel importante en las LAI (1,23,24,28).
1.5. Una cultura de seguridad
El concepto de “cultura de seguridad”, tal como se describe en este informe, alienta a todos los laboratorios de diagnóstico para humanos y animales a promover una cultura organizativa de evaluación sistemática de todos los procesos y procedimientos laborales, a fin de identificar los riesgos asociados e implementar planes para mitigar esos riesgos. Además del riesgo de peligro biológico, que a menudo se desconoce, asociado con la manipulación de muestras para diagnóstico, cada sección del laboratorio de diagnóstico tiene procedimientos y procesos para manipular agentes infecciosos conocidos que implican un riesgo excesivo de exposición y de una posible infección y/o lesión ocupacional. Esos riesgos normalmente están asociados con defectos de diseño o con la falta de procedimientos de seguridad y capacitación, o con que estos no son adecuados (1,2). Además, las operaciones cotidianas de un laboratorio de diagnóstico para humanos y animales difieren notablemente de las de un laboratorio académico o de investigación y requieren pautas de bioseguridad diferentes; esas diferencias motivaron el enfoque de este informe sobre las comunidades de laboratorios médicos, sus riesgos ocupacionales, el potencial de exposición y las oportunidades para mitigar esos riesgos.
El establecimiento satisfactorio de una cultura de seguridad requiere que la seguridad en el laboratorio pase a ser una prioridad integral y evidente de la organización, adoptada ante todo por la gerencia superior y con el apoyo de la infraestructura concomitante que se necesita para promover comportamientos seguros entre los empleados (29–31). Conforme lo requieren las Enmiendas sobre mejora de laboratorios clínicos (Clinical Laboratory Improvement Amendments), el Colegio de Patólogos de Estados Unidos (College of American Pathologists) y otros organismos de acreditación, el director de un laboratorio debe asumir la responsabilidad de:
- establecer y hacer cumplir una política para una cultura de seguridad dentro del laboratorio;
- identificar tantos peligros como sea posible y especificar prácticas y procedimientos que minimizarán o eliminarán esos peligros;
- asegurarse de que todos los integrantes del personal reciban instrucciones sobre evaluaciones de riesgo y estén comprometidos con su realización, y que puedan demostrar que son capaces de identificar peligros de laboratorio en sus entornos de trabajo individuales;
- asegurarse de que todo el personal haya recibido capacitación y sea competente en las prácticas y técnicas estándares que minimizan los peligros identificados en el lugar de trabajo;
- proporcionar una vía para que el personal identifique peligros y presentar estrategias de mitigación de riesgos a la gerencia; y
- educar al personal médico y de enfermería acerca de la obtención y el transporte seguro de muestras, a fin de garantizar su seguridad y la del personal del laboratorio que reciba las muestras clínicas.
1.6. Diseño del laboratorio y planificación arquitectónica para microbiología
El diseño del laboratorio es fundamental para la seguridad de los empleados del laboratorio, el personal hospitalario y los pacientes. En el documento del Instituto de Estándares Clínicos y de Laboratorio, Diseño del laboratorios; pauta aprobada (Laboratory Design; Approved Guideline) (32), se aborda el diseño de laboratorios detalladamente. Debido a que reparar un espacio de trabajo de laboratorio mal diseñado es difícil o incluso imposible, el diseño justifica una planificación cuidadosa y la consideración de problemas de seguridad. A continuación se presentan sugerencias a considerar en el diseño o la renovación de laboratorios de diagnóstico. Aunque no hay un requisito en los estándares nacionales para la superficie de espacio por persona que trabaja en el laboratorio, entre 28 y 33 metros cuadrados (300 y 350 pies cuadrados) por persona en un departamento de laboratorio es una cifra razonable para proporcionar un área de trabajo segura. Lo ideal es que haya un espacio de 1,5 metros (5 pies) como mínimo entre el empleado (en una silla de laboratorio) y cualquier objeto que esté detrás del empleado, para proporcionar un área razonable para maniobrar.
- Las opciones de diseño para los laboratorios de microbiología deben incluir un componente cerrado del laboratorio en general, separado de las otras secciones del laboratorio por puertas que se puedan cerrar. Si bien no es obligatorio, también se recomienda contar con flujo de aire direccional hacia adentro desde el laboratorio principal hacia el laboratorio de microbiología en los laboratorios de diagnóstico recién construidos. Si el centro tiene un diseño abierto y no tiene un techo falso, el laboratorio de microbiología puede tener paredes de vidrio o de plexiglás transparentes, que le dan un aspecto abierto pero brindan una barrera de seguridad del piso al techo ante posibles exposiciones a aerosoles. Si hay un falso techo colocado, las paredes transparentes deben penetrar la cubierta más allá del techo para sellar el área. En un laboratorio construido anteriormente que no cuente con aire ambiental direccional, se recomienda el funcionamiento continuo de gabinetes de seguridad biológica (biological safety cabinets, BSC) para que los aerosoles potenciales tengan cierta dirección.
- El aire direccional se recomienda para crear zonas de contención que continúen con una presión negativa creciente hacia espacios de trabajo en los que se realizan procedimientos de laboratorio de mayor riesgo. Debe existir la posibilidad de ajustar y balancear los sistemas de manejo de aire dentro de la sala del laboratorio de microbiología, con flujo de aire direccional desde el corredor hacia el laboratorio de microbiología y desde el laboratorio de microbiología general hacia los laboratorios separados y cerrados especializados en tuberculosis, micología y virología.
- En los laboratorios de microbiología, es esencial que el supervisor y el director del laboratorio, junto con un profesional de bioseguridad, aporten comentarios sobre las necesidades especiales de las instalaciones de laboratorio nuevas. El acceso a la sección de microbiología se debe limitar al personal únicamente. La sección de microbiología debe tener instalaciones para descontaminación o un contrato para manejo de residuos médicos implementado, y debe contar con un lavabo para lavarse las manos. Los lavabos operados sin manos (con pedal) son obligatorios en instalaciones con un nivel de bioseguridad (biosafety level, BSL)-3 y están recomendados en las instalaciones con un BSL-2. Las superficies de las mesas de trabajo deben ser de materiales impermeables; los materiales laminados pueden deslaminarse y volverse difíciles de desinfectar. En los BSC con ventilación hacia el exterior, el manejo del aire se debe planificar cuidadosamente para asegurarse de que el aire se ventile al exterior después de filtrarlo y de que los conductos de ventilación al exterior estén colocados lejos de las unidades de ingreso de aire a las instalaciones. En los laboratorios que tienen muchas clases de BSC, los materiales peligrosos que está permitido manipular dentro de la unidad específica (1) se deben indicar claramente al personal (mediante etiquetas). Un laboratorio de microbiología general para humanos o animales debe tener un BSL-2.
- Si no hay instalaciones con BSL-3 disponibles, se puede utilizar un BSL-2 más el flujo de aire negativo y el uso de precauciones respiratorias para algunos agentes, siempre y cuando se haya realizado una evaluación del riesgo.
- En laboratorios de análisis para humanos, lo ideal es que los laboratorios separados de tuberculosis y virología que manipulan cultivos para la identificación y caracterización cumplan los requisitos del BSL-3. En los laboratorios de diagnóstico de virología para animales en los que la mayoría de los virus manipulados no son patógenos humanos, la práctica es cumplir con los requisitos del BSL-2 a menos que un análisis de riesgo indique que hay una alta probabilidad de que un agente de una nuestra necesite contención de BSL-3. Se deben realizar evaluaciones de riesgo en cada centro a fin de incluir la consideración de los riesgos específicos que se encuentran en cada laboratorio.
- Las áreas de recepción y preparación de los laboratorios de microbiología deben estar diseñadas con suficiente espacio para que quepa la mayor cantidad de muestras prevista. Esa área requiere un BSC clase IIA2, un lavabo para lavarse las manos y una estación de emergencia para lavado de ojos. Los conectores de teléfono, computadoras y tomacorrientes deben estar incluidos en el módulo (el uso de tecnología inalámbrica puede reducir la necesidad de cableado de teléfonos y computadoras en cada módulo), junto con un espacio para refrigerador en el que quepan uno o dos refrigeradores contiguos con puertas de vidrio o un refrigerador doble que permita un fácil acceso al personal de preparación.
- El laboratorio general debe tener espacios de trabajo con asientos diseñados con suficiente espacio para que haya una computadora en cada estación. Se deben preferir las mesas de trabajo con estantes para guardar cosas ubicados sobre el centro de la mesa; esto proporciona espacio para guardar suministros sin que haya desorden en el área de trabajo. Los estantes para almacenamiento deben tener un borde de 1 cm (1/2 pulgada) para asegurar de que las sustancias químicas no puedan deslizarse desde el estante. La iluminación colocada debajo del estante es la mejor para iluminar el área de trabajo. Por comodidad, se recomienda contar con tomacorrientes en cada estación de trabajo, además de conectores de teléfono y computadora. El uso de mecheros a gas ya no es una recomendación universal.
- Si es posible, ubicar los tanques de dióxido de carbono y gas anaeróbico fuera del laboratorio en sí (preferentemente, protegidos o incluso instalados fuera del edificio). Colocar los tanques fuera del laboratorio o del edificio en un área cerrada permitirá un acceso sencillo para el reemplazo de los tanques. Cuando corresponda, las líneas que conectan los tanques de gas con áreas específicas del laboratorio deben ser de tubería sintética para permitir su reubicación en el futuro si es necesaria. Se deben hacer arreglos para realizar una lectura diaria de los medidores en el laboratorio a menos que sea posible instalar alarmas. Los tanques de gas deben estar sujetados individualmente (29).
- Si los residuos se descontaminan en el lugar antes de su desecho, el laboratorio debe tener un autoclave suficientemente grande para sus necesidades. Ubique el autoclave en un área bien ventilada o asegúrese de que el escape se realice a través de una campana de captura colocada encima del mismo. Lo ideal es que el laboratorio de micobacteriología tenga su propio autoclave. Se pueden instalar autoclaves de doble puerta, de forma que un lado se abra en el laboratorio de micobacteriología y el otro lado a un área de desecho usada por el laboratorio para desechar los demás residuos. Se recomienda la validación de los ciclos del autoclave para la descontaminación efectiva de las cargas previstas además del mantenimiento regular y el programa de aseguramiento de la calidad.
- En el laboratorio de diagnóstico óptimo, se planificaría — un área de laboratorio general de microbiología que pueda aislarse del laboratorio principal, es decir de otras disciplinas del laboratorio; — salas separadas de micobacteriología, virología y micología (con presión negativa en relación con el laboratorio principal y un BSC clase IIA2) con conectores de teléfono y computadora; — espacio suficiente o salas separadas para análisis de control de calidad, recepción de suministros y almacenamiento de registros; y — una sala extra para expansión futura a fin de ofrecer más servicios, p. ej., análisis moleculares o de virología. Es posible que la sala deba ser renovada para incluir un BSC clase IIA2, flujo de aire direccional, conectores de teléfono y dispositivos de comunicación como intercomunicadores. Los conectores de teléfono y dispositivos de comunicación deben estar en todas las salas de ese tipo.
- Asegúrese de que el espacio actual y futuro de microbiología esté diseñado para una cantidad suficiente de instrumentos para hemocultivo, instrumentos de identificación automática, inmunoensayos enzimáticos automáticos, extracción de ácidos nucleicos y plataformas de análisis, e instrumentos para transferencia con pipeta, refrigeradores, instrumentos automáticos para tinción de Gram, instrumentos para estriado de placas automático, BSC, congeladores y estaciones adicionales con computadoras para uso opcional. Algunos instrumentos de identificación necesitan una superficie de por lo menos 2,4 m (8 pies) para la unidad, la impresora y los módulos. Si el laboratorio proporcionará el servicio, debe prever una cámara anaeróbica de tamaño mediano, de alrededor de 1,8 m (6 pies) de superficie. Las evaluaciones de riesgos deben incluir la evaluación de los aerosoles infecciosos que podría producir el equipo de procedimientos automáticos, a fin de determinar si se recomienda la ventilación de contención.
- Contar con especialistas certificados en laboratorios es tan importante para un centro médico como contar con especialistas certificados y altamente capacitados en medicina y cirugía. Es lo mínimo que merecen los pacientes si los resultados de laboratorio se utilizan como guía para la atención del paciente. Además, el personal diplomado por la Junta Estadounidense de Microbiología Médica (American Board of Medical Microbiology) o la Junta Estadounidense de Inmunología de Laboratorios Médicos (American Board of Medical Laboratory Immunology), o especialistas equivalentes en posiciones de liderazgo, son incorporaciones valiosas para los laboratorios que reciben y manipulan microbios. El uso de sus habilidades en la dirección del laboratorio o como consultores es invaluable y muy recomendado. También se deben reclutar y conservar especialistas en tecnología, en especial en microbiología, donde el criterio de interpretación es fundamental para el análisis de las muestras y, en última instancia, afecta en forma directa la atención de los pacientes y su evolución.
2. Evaluación del riesgo biológico y pautas de bioseguridad
2.1. Evaluación de riesgos
El director del laboratorio es el responsable final de identificar posibles peligros, evaluar los riesgos asociados con esos peligros y establecer precauciones y procedimientos estándares para minimizar la exposición de los empleados a esos riesgos. Dado que la identidad de un agente infeccioso inicialmente se desconoce en el laboratorio clínico, la recomendación general es que se aplique el estándar del nivel de bioseguridad (BSL)-2 y las prácticas especiales de Bioseguridad en laboratorios microbiológicos y biomédicos, 5.ª edición (1) para todo el trabajo realizado en un laboratorio clínico, y que se utilicen las precauciones estándares de la Administración de Seguridad y Salud Ocupacionales (Occupational Safety and Health Administration, OSHA) (guantes, batas y gafas protectoras) (33) y las prácticas de BSL-2 (2) durante la manipulación de todas las muestras de sangre y fluidos corporales. En (34,35) hay otros recursos exhaustivos disponibles. La evaluación de riesgos, como se la detalla aquí y en la Sección 12, puede determinar que se justifica un aumento o una disminución de las prácticas o instalaciones de BSL (Figura 1).
La evaluación cualitativa del riesgo biológico es un proceso subjetivo que involucra criterios profesionales. Debido a las incertidumbres o a que no hay datos científicos suficientes, las evaluaciones de riesgo a menudo se basan en conocimientos o información incompletos. También hay limitaciones inherentes y suposiciones realizadas en el proceso, y la percepción de qué es un riesgo aceptable varía de una persona a otra. El riesgo nunca es cero, y siempre existe el potencial de que haya errores humanos.
Identificar posibles peligros en el laboratorio es el primer paso para realizar una evaluación de los riesgos. Hay muchas categorías de peligro microbiológico desde el momento en que se recolecta una muestra hasta que es desechada permanentemente. Un enfoque integral para identificar los peligros en el laboratorio incluirá información de diversas fuentes. Los métodos para recabar información sobre peligros pueden incluir el uso de referencias, recorridos, entrevistas, inspecciones detalladas, revisiones de incidentes, análisis de flujo de trabajo y procesos, y el diseño de las instalaciones.
No existe un único enfoque estándar ni un método correcto para realizar una evaluación de riesgos; sin embargo, existen varias estrategias, como el uso de una matriz de establecimiento de prioridades de riesgos, la realización de un análisis de peligros laborales o la enumeración de posibles ejemplos de problemas durante un procedimiento, una tarea o una actividad. El proceso involucra los cinco pasos siguientes:
-
Identificación de los peligros asociados con un agente o material infeccioso.
-
Identificación de las actividades que podrían provocar la exposición al agente o material.
-
Consideración de las competencias y la experiencia del personal del laboratorio.
-
Evaluación y asignación de prioridades a los riesgos (evaluación de la probabilidad de que una exposición produzca una infección adquirida en el laboratorio [LAI] y de la gravedad de las consecuencias si se produce dicha infección).
-
Desarrollo, implementación y evaluación de controles para minimizar el riesgo de exposición.
La estandarización del proceso de evaluación de riesgos en la institución puede mejorar significativamente la claridad y la calidad de ese proceso. La capacitación del personal en materia de evaluación de riesgos es fundamental para lograr esos objetivos.
2.1.1. Paso 1. Identificación de los peligros asociados con un agente o material infeccioso.
- El potencial de infección, determinado por las vías más comunes de transmisión (es decir, ingestión por contaminación de superficies/fomes a las manos y la boca; inoculación percutánea por cortes, pinchazos con agujas, piel no intacta o mordeduras; contacto directo con membranas mucosas e inhalación de aerosoles) (Tabla 1);
- La frecuencia y la concentración de los organismos aislados de forma rutinaria, determinadas por tipo de muestra, datos del paciente (de la persona o de la población hospitalaria), datos epidemiológicos y origen geográfico de la muestra;
- Factores intrínsecos (si se conoce el agente)
— Patogenicidad, virulencia e infectividad/transmisibilidad de la cepa;
— Modo de transmisión (el modo de transmisión en el laboratorio puede diferir de la transmisión natural);
— Dosis infecciosa (la cantidad de microorganismos necesarios para iniciar una infección puede variar considerablemente según el organismo específico, el paciente y la vía de exposición);
— Forma (estadio) del agente (p. ej., presencia o ausencia de pared celular, espora en comparación con vegetación, conidios en comparación con hifas para los agentes micóticos);
— Invasividad de un agente (capacidad de producir ciertas enzimas); y
— Resistencia a los antibióticos. - Indicadores de posibles patógenos de alto riesgo que pueden requerir que se continúe el trabajo en un gabinete de seguridad biológica (BSC), como
— Colonias diminutas de crecimiento lento a las 24 - 48 horas que en la tinción de Gram muestran bacilos gramnegativos o cocobacilos gramnegativos;
— Crecimiento lento en frascos de hemocultivo (es decir, positivo ≥ 48 horas), que en la tinción de Gram muestra bacilos pequeños gramnegativos o cocobacilos gramnegativos;
— Crecimiento solamente en agar chocolate;
— Crecimiento rápido de colonias planas, no pigmentadas, irregulares, con proyecciones en forma de coma y aspecto de vidrio molido;
— Tinción de Gram que muestra bacilos grampositivos con forma de furgón de carga, con o sin esporas.
2.1.2. Paso 2. Identificación de las actividades que podrían provocar la exposición al agente o material.
- Las instalaciones (p. ej., BSL-2, BSL-3, diseño de planta abierta [más riesgo] en comparación con áreas o salas separadas para actividades específicas [menos riesgo], espacio suficiente en comparación con espacio abarrotado, flujo de trabajo, equipo presente);
- El equipo (p. ej., en el caso de BSC no certificados, tubos de centrífugas agrietados, autoclaves con mantenimiento inadecuado, recipientes para objetos cortopunzantes demasiado llenos, mecheros Bunsen);
- Potencial para la generación de aerosoles y gotitas.
Los aerosoles se pueden generar a partir de la mayoría de los procedimientos rutinarios de laboratorio, pero a menudo son indetectables. Los siguientes procedimientos se han asociado con la generación de aerosoles infecciosos.
— Manipular agujas, jeringas y objetos cortopunzantes-
Subcultivar frascos de hemocultivos positivos, preparar frotis
-
Expulsar aire de tubos o frascos
-
Retirar agujas de sus protectores
-
Separar agujas de jeringas
-
Aspirar y transferir de fluidos corporales
-
Obtener tejidos
-
Quemar asas
-
Enfriar asas en medios de cultivo
-
Subcultivar y estriar medios de cultivo
-
Expulsar la última gota de una pipeta (incluidas las pipetas Eppendorff)
-
Centrifugación
-
Preparar cultivos, medios de inoculación
-
Mezclar, combinar, moler, agitar, tratar con ultrasonido y tratar con vórtice muestras o cultivos
-
Verter, separar o decantar muestras líquidas
-
Retirar tapas o hisopos de recipientes de cultivo, abrir cultivos liofilizados, abrir criotubos
-
Derramar material infeccioso
-
Filtrar muestras al vacío
-
Preparar aislados para análisis automático de identificación/susceptibilidad
-
Preparar frotis, realizar fijación con calor, realizar tinción de portaobjetos
-
Realizar una prueba de catalasa
-
Realizar análisis de serología, pruebas rápidas de antígenos, preparaciones húmedas y aglutinaciones en portaobjetos
-
Arrojar objetos contaminados a los desechos con peligro biológico
-
Limpiar materiales derramados
-
- Uso de animales;
- Uso de objetos cortopunzantes;
- Producción de grandes volúmenes o concentraciones de posibles patógenos;
- Equipo usado o mantenido incorrectamente;
Algunos ejemplos de posibles peligros son la disminución de la habilidad manual o del tiempo de reacción de los empleados que usan guantes, la reducción de la capacidad de respirar con mascarillas N95 o equipo de protección personal (personal protective equipment, PPE) que no es del tamaño adecuado. - Trabajar solo en el laboratorio.
No existe ningún peligro biológico inherente al hecho de que una persona trabaje sola en el laboratorio; no obstante, el supervisor es responsable de saber si se asigna a una persona a trabajar sola y en qué momento es asignada. Debido a que asignar a una persona a trabajar sola es una decisión específica de cada centro, se debe realizar una evaluación de riesgos que tenga en cuenta todas las consideraciones de seguridad, incluidos el tipo de trabajo, la seguridad física, la seguridad del laboratorio, la respuesta ante emergencias, la posible exposición o lesión y otras cuestiones específicas del laboratorio.
2.1.3. Paso 3. Consideración de las competencias y la experiencia del personal del laboratorio.
- Edad (los empleados más jóvenes o inexpertos podrían tener un riesgo mayor);
- Predisposición genética y déficits nutricionales, estado inmunológico/médico (p. ej., enfermedad subyacente, uso de fármacos inmunosupresores, afecciones respiratorias crónicas, embarazo, piel no intacta, alergias, uso de medicamentos que reducen la habilidad manual o el tiempo de reacción);
- Educación, capacitación, experiencia, competencia;
- Estrés, fatiga, estado mental, carga de trabajo excesiva;
- Percepción, actitud, adhesión a las precauciones de seguridad; y
- Las vías más comunes de exposición o ingreso al cuerpo (es decir, piel, membranas mucosas, pulmones y boca) (Tabla 1).
2.1.4. Paso 4. Evaluación y asignación de prioridades a los riesgos.
Los riesgos se evalúan según la probabilidad de que ocurran y la gravedad de las consecuencias (Tabla 2).
- Probabilidad de que ocurra
— Casi segura: se prevé que ocurra
— Probable: podría ocurrir en algún momento
— Moderada: podría ocurrir, pero no es probable
— Improbable: podría ocurrir, pero es raro
— Rara: podría ocurrir, pero probablemente nunca suceda - Gravedad de las consecuencias
Las consecuencias pueden depender de la duración y la frecuencia de la exposición, así como de la disponibilidad de vacunas y del tratamiento adecuado. A continuación se proporcionan ejemplos de consecuencias para empleados individuales.
— Colonización que lleva a estado de portador
— Infección asintomática
— Toxicidad, oncogenicidad, alergenicidad
— Infección aguda o crónica
— Enfermedad, tratamiento médico
— Enfermedad y secuelas
— Muerte
2.1.5. Paso 5. Desarrollo, implementación y evaluación de controles para minimizar el riesgo de exposición.
- Controles de ingeniería
Si es posible, primero se debe aislar y contener el peligro en la fuente.
— Contención primaria: BSC, recipientes para objetos cortopunzantes, pocillos de seguridad en la centrífuga, protectores contra salpicaduras, objetos cortopunzantes más seguros (p. ej., combinaciones de agujas/jeringas autorretráctiles, escalpelos desechables) y soportes para pipetas
— Contención secundaria: características del diseño del edificio (p. ej., flujo de aire direccional o presión de aire negativa, lavabos para lavarse las manos, puertas cerradas, entrada de doble puerta) - Controles administrativos y controles de las prácticas laborales
— Adhesión estricta a prácticas estándares y especiales de microbiología (1)
— Adhesión a avisos y procedimientos operativos estándares
— Lavado frecuente de las manos
— Usar PPE solamente en el área de trabajo
— Minimizar los aerosoles
— Prohibir que se coma, beba, fume o mastique chicle
— Limitar el uso de agujas y objetos cortopunzantes y prohibir que las agujas se vuelvan a tapar
— Minimizar las salpicaduras (p. ej., mediante el uso de “pañales” de laboratorio en la superficie de las mesas o tapando los tubos con gasa al abrirlos)
— Vigilar el uso adecuado de procedimientos de limpieza, descontaminación y desecho de residuos
— Implementar un flujo de trabajo que vaya de “limpio” a “sucio”
— Seguir las recomendaciones para la vigilancia médica y la salud ocupacional, inmunizaciones, informe de incidentes, primeros auxilios, profilaxis posterior a la exposición
— Capacitación
— Implementar procedimientos de respuesta a emergencias - PPE (como último recurso para proporcionar una barrera contra el peligro)
— Guantes para manipular todos los materiales, recipientes, equipo o superficies potencialmente contaminados
— Protección facial (protectores faciales, gafas para salpicaduras usadas con mascarillas, mascarillas con protector ocular incorporado) si no se dispone de BSC o de protectores contra salpicaduras. Sin embargo, la protección facial no reemplaza adecuadamente a un BSC. En BSL-2 o más, se requiere un BSC o un dispositivo de contención similar para procedimientos con potencial de salpicaduras o aerosoles (Tabla 3).
— Delantales y batas de laboratorio para prevenir la exposición de la ropa de calle, y guantes o vendajes para proteger la piel no intacta
— Protección respiratoria adicional si la evaluación de riesgos determina que es necesaria - Análisis de seguridad laboral
Una manera de iniciar una evaluación de riesgos es realizar un análisis de seguridad laboral para los procedimientos, tareas o actividades realizados en cada estación de trabajo o laboratorio específico, enumerando los pasos que se siguen en un protocolo dado y los peligros asociados con ellos, para luego determinar cuáles son los controles necesarios en función del presunto organismo (Tabla 3, Apéndice). Tomar precauciones que vayan más allá de las prácticas estándares y especiales para BSL-2 podría estar indicado en las siguientes circunstancias:
— Solicitud de análisis por sospecha de Mycobacterium tuberculosis u otras micobacterias, hongos filamentosos, agentes de bioterrorismo y fiebre viral hemorrágica
— Sospecha de organismo de alto riesgo (p. ej., Neisseria meningitidis)
— Trabajo con animales
— Trabajo con grandes volúmenes o cultivos muy concentrados
— Estado inmunológico comprometido de un integrante del personal
— Capacitación de un integrante del personal nuevo o inexperto
— Preferencia del tecnólogo - Supervisión de la eficacia de los controles
La evaluación de riesgos es un proceso continuo que requiere al menos una revisión anual debido a los cambios en los patógenos nuevos y emergentes, y en las tecnologías y el personal.
— Revisar los informes de incidentes, exposiciones, enfermedades y cuasi accidentes.
— Identificar las causas y los problemas; introducir cambios, proporcionar capacitación de seguimiento.
— Realizar inspecciones rutinarias del laboratorio.
— Repetir la evaluación de riesgos periódicamente.
2.2. Principios de bioseguridad (1)
2.2.1. Contención
“Contención” es un término que describe métodos seguros para manejar materiales infecciosos en el laboratorio a fin de reducir o eliminar la exposición de los empleados del laboratorio, otras personas y el medio ambiente.
- La contención primaria protege al personal y al entorno inmediato del laboratorio y se logra mediante un buen uso de técnicas de microbiología y el uso del equipo de seguridad adecuado.
- La contención secundaria protege al ambiente externo del laboratorio y se logra mediante el diseño y la construcción de las instalaciones.
2.2.2. Niveles de bioseguridad (Tabla 4)
Los BSL proporcionan los niveles adecuados de contención necesaria para las operaciones realizadas, las vías documentadas o sospechadas de transmisión del agente infeccioso y la función o las actividades del laboratorio. Los cuatro BSL, designados con números del 1 al 4, se basan en combinaciones de práctica y técnicas de laboratorio, equipo de seguridad (barreras primarias) e instalaciones del laboratorio (barreras secundarias). Cada BSL amplía el nivel anterior para proporcionar contención adicional. Los directores de laboratorio son los responsables de determinar qué BSL es adecuado para trabajar en sus laboratorios específicos.
- El BSL-1 es adecuado para trabajar con agentes que no hayan demostrado en forma sistemática provocar enfermedades en humanos adultos sanos (es decir, laboratorios que no trabajan con agentes que provocan enfermedades con muestras de humanos o animales).
- El BSL-2 es adecuado para manipular agentes de riesgo moderado que provocan enfermedades humanas con diversos grados de gravedad mediante la ingestión o la exposición por vía percutánea o por las membranas mucosas (es decir, laboratorios de diagnóstico clínico para humanos y animales).
- El BSL-3 es apropiado para el trabajo con agentes autóctonos o exóticos que han demostrado poseer potencial para transmisión por aerosoles y con agentes que pueden provocar infecciones graves y potencialmente mortales (p. ej., laboratorios de tuberculosis).
- El BSL-4 se reserva para el trabajo con agentes exóticos que tienen un riesgo individual alto de enfermedades que ponen en peligro la vida transmitidas por aerosoles infecciosos y para las que no existe tratamiento (p. ej., los virus Ébola, Marburg y de la familia Poxviridae). Esos laboratorios de alta contención tienen requisitos complejos y avanzados para sus instalaciones.
2.3. Hojas de datos de seguridad de materiales para organismos y sustancias químicas
Las hojas de datos de seguridad de materiales (Material Safety Data Sheets, MSDS) para sustancias químicas están disponibles a través del fabricante, el proveedor o un sitio web oficial. La División de Salud y Seguridad Ocupacional (Division of Occupational Health and Safety) de los Institutos Nacionales de Salud ha promulgado normas para el manejo de organismos manipulados genéticamente y tiene instrucciones adicionales para acceder a las MSDS (http://dohs.ors.od.nih.gov/material_safety_data_main.htm).
2.4. Manual de bioseguridad
- El director del laboratorio es responsable de asegurarse de que se elabore un manual de bioseguridad específico para el laboratorio, que sea adoptado, que sea revisado anualmente y de que todo el personal del laboratorio tenga acceso al mismo. Todos los empleados del laboratorio deben leer este manual, y el director debe llevar un registro de los integrantes del personal que lo han leído.
- El manual debe ser revisado y actualizado anualmente y siempre que haya un cambio en los procedimientos o las políticas. Se recomienda la capacitación anual en prácticas de bioseguridad para todo el personal que tenga acceso al laboratorio. Los temas recomendados incluyen:
— Políticas de seguridad institucionales y del laboratorio
— Responsabilidades de la gerencia, el supervisor y el personal
— Reglamentaciones y pautas recomendadas
— Vías de exposición en el laboratorio
— Evaluación de riesgos e informe de exposiciones
— Principios y prácticas de bioseguridad
— Precauciones estándar para la manipulación segura de materiales infecciosos
— Procedimientos operativos estándares
— Comunicación de peligro y signos de peligro biológico
— Controles de ingeniería
— Controles administrativos y controles de las prácticas laborales
— PPE
— Cuándo y cómo trabajar en un BSC
— Transporte de materiales con peligro biológico
— Procedimientos de emergencia
— Descontaminación y desecho de residuos con peligro biológico
— Programa de capacitación y documentación
— Vigilancia médica y procedimientos de evaluación de exposiciones
3. Prácticas fundamentales de seguridad en los laboratorios de diagnóstico
Muchos procedimientos, pautas y principios de seguridad son aplicables a todas las secciones del laboratorio de diagnóstico. Las recomendaciones presentadas en esta sección representan un panorama amplio de la seguridad en todo el laboratorio. En Bioseguridad en laboratorios microbiológicos y biomédicos (BMBL-5) y en el Manual de bioseguridad en el laboratorio de la Organización Mundial de la Salud se pueden encontrar recomendaciones más detalladas (1,36).
Los hospitales, laboratorios clínicos, departamentos de salud estatales y locales, los CDC y la Sociedad Estadounidense de Microbiología (American Society for Microbiology) han establecido y/o publicado pautas que se deben seguir cuando se han liberado o se podrían liberar presuntos agentes de bioterrorismo en la comunidad. Sin embargo, los análisis de rutina de laboratorio clínico pueden aportar la primera evidencia de un evento inesperado de bioterrorismo. Las muestras clínicas para análisis de rutina también pueden contener agentes infecciosos inusuales o exóticos cuya amplificación en cultivos es peligrosa. Estos agentes suelen ser difíciles de identificar, y el tecnólogo de rutina podría continuar trabajando en el cultivo mediante pases, tinciones repetidas, análisis de ácidos nucleicos, neutralización y otros métodos. Esta continuación de los análisis pone al tecnólogo y a otras personas del laboratorio en riesgo de contraer una infección. Lo ideal es que estas muestras no sean procesadas ni analizadas en el laboratorio de rutina, y se pueden retirar del flujo de análisis si se conoce el agente sospechoso. Las relaciones con el laboratorio de salud pública estatal, y posteriormente, con la Red de Respuesta de Laboratorios (Laboratory Response Network) son fundamentales para esta iniciativa.
Una vez que se ha iniciado el proceso de análisis, el tecnólogo debe contar con instrucciones claras y precisas sobre cuándo solicitar ayuda al supervisor y/o al director del laboratorio.
3.1. Recepción de muestras y estación de registro/preparación
- Las muestras para microbiología se deben recibir en recipientes no contaminados que estén intactos y que sean compatibles con la política de recolección de muestras del laboratorio.
- El uso de tubos neumáticos para el transporte de muestras es aceptable para la mayoría de las muestras, pero puede estar contraindicado en muestras que no tienen tapas herméticas, como los recipientes para orina; estos se deben entregar en mano (consulte 3.1.6). Adopte procedimientos operativos estándares (standard operating procedures, SOP) en caso de que se considere el transporte de muestras irreemplazables mediante esos sistemas.
- Lo ideal es que todas las muestras en un centro con un nivel de bioseguridad (BSL)-2 o superior sean procesadas en un gabinete de seguridad biológica (BSC) respetando las prácticas de seguridad del BSC. Si el laboratorio no tiene un BSC, el empleado que procese las muestras entrantes debe usar una bata de laboratorio y guantes, emplear un protector contra salpicaduras eficaz y seguir respetando las precauciones universales. Es posible que sea necesario tomar precauciones adicionales si así lo requieren las evaluaciones de riesgo específicas del centro.
- Limite el uso de un BSC de 1,2 m (4 pies) de ancho para inocular placas y preparar frotis a un empleado a la vez, que lleve puesto el equipo de protección personal (PPE) adecuado. En los BSC de 1,8 m (6 pies) de ancho se pueden incluir equipo y materiales de análisis adicionales. Verifique las recomendaciones del fabricante antes de permitir que dos empleados trabajen simultáneamente en el gabinete más grande, y permita ese uso únicamente después de realizar una evaluación de riesgos.
- El PPE mínimo para el área de preparación general es bata y guantes. En microbiología, se recomienda una mascarilla quirúrgica, pero es opcional si se usa un BSC. En los laboratorios de micobacteriología y virología en los que se manipulan organismos, los empleados deben usar una mascarilla N95 con prueba de ajuste o seleccionar otra protección respiratoria adecuada según lo indicado por la evaluación de riesgos. Por lo general, no se necesita una mascarilla N95 para los niveles de biocontención hasta el BSL-2, aunque proporciona un mayor grado de protección que una mascarilla quirúrgica. Las prácticas de seguridad del BSC se deben respetar en todo momento. Las muestras para análisis micobacteriano, micótico, viral y molecular podrían requerir protecciones específicas adicionales.
3.1.1. Recipientes con fugas
- Envíe las muestras al laboratorio en bolsas para transporte que aíslen la solicitud de análisis del paciente de las muestras; limite siempre las bolsas a un paciente para evitar la identificación incorrecta y la contaminación cruzada.
- Solicite una nueva muestra si un recipiente está roto o si su contenido se ha derramado. Estos recipientes no son aceptables para cultivo porque es posible que el contenido se haya contaminado. Documente el incidente y notifique al supervisor si hubo una exposición.
- Examine visualmente los recipientes para detectar fugas en el momento de su llegada y antes de colocarlos en agitadores, centrífugas, soportes, sistemas de toma de muestras de tubos cerrados (sonda de perforación de tapas), estaciones de obtención automática de alícuotas o sistemas de preparación automática de portaobjetos, o en cintas transportadoras.
- Lleve un registro y documente todos los incidentes de tubos agrietados, tapas flojas y recipientes con fugas. Los aumentos de eventos documentados pueden indicar la necesidad de aclarar o de reforzar las políticas de aceptación de muestras, o de mejorar las prácticas de recolección o transporte de muestras, o podrían identificar números de lote de recipientes defectuosos.
- Considere todos los recipientes con esputo como si provinieran de pacientes con tuberculosis o neumonía, y manipúlelos con cuidado. La contaminación externa causada por el cierre inadecuado de las tapas puede contaminar los guantes del personal del laboratorio y todo el contenido del BSC. Si la muestra tiene una fuga o está contaminada, considere su rechazo y la solicitud de otra muestra si es factible. Cámbiese los guantes y deséchelos después de la desinfección y la limpieza. (Se recomienda una solución 1:10 de lejía o un desinfectante adecuado.) Documente la contaminación externa para propósitos de elaboración de informes.
- Considere todos los frascos de hemocultivo como si provinieran de pacientes posiblemente infectados (p. ej., por el virus de la inmunodeficiencia humana [VIH] o hepatitis) y manipúlelos adecuadamente. Si existe alguna inquietud sobre la contaminación externa, desinfecte cuidadosamente el exterior de los tubos o los frascos antes de insertarlos en los instrumentos para hemocultivo. Cámbiese los guantes y deséchelos después de la limpieza y descontaminación del área inmediata. Documente la contaminación externa para propósitos de elaboración de informes.
- Los recipientes con fugas que contienen heces pueden ser un peligro para el tecnólogo, pueden contaminar el laboratorio o pueden ser una oportunidad para que se mezclen especies y/o para que se produzca contaminación que podría producir un resultado falso. Estas muestras se deben desechar si es factible hacerlo, y se debe solicitar una nueva muestra. De lo contrario, desinfecte el exterior del recipiente antes de cultivar el contenido, y cámbiese y deseche los guantes antes de continuar. Documente la contaminación externa para propósitos de elaboración de informes.
- Es posible que las muestras virales con recipientes dañados o con fugas se deban desechar antes de abrirlos. Comuníquese con el supervisor para recibir instrucciones sobre si debe seguir procesando la muestra o no, y esté preparado para notificar a la persona que envió la muestra y solicitar otra muestra.
3.1.2. Contaminación visible del exterior de los recipientes
- Considere todos los recipientes de muestras como posiblemente contaminados.
- No dependa de la contaminación externa visible para confirmar la posible fuente de contaminación.
- Limpie la contaminación visible con una toalla o paño de gasa humedecido con un descontaminante aceptable, como una dilución 1:10 de lejía doméstica, o use el desinfectante establecido del laboratorio. Asegúrese de que la etiqueta y el código de barras no estén ocultos antes de continuar con el análisis de la muestra.
3.1.3. Tapas flojas
- Siempre sujete el tubo o el exterior del recipiente de la muestra, no el tapón o la tapa, al levantar tubos o recipientes con muestras, a fin de evitar derrames y rotura.
- Asegúrese de que las tapas de todos los recipientes con muestras, tubos para recolección de sangre y tubos para muestras estén firmemente cerradas antes de continuar con el análisis o el almacenamiento.
3.1.4. Procedimientos operativos
- Asegúrese de que la colocación de las muestras, el flujo de las muestras y el flujo de trabajo operativo en la mesa sean unidireccionales (es decir, de áreas limpias a áreas sucias) y uniformes para todos los operadores, a fin de maximizar el uso eficaz de los controles de ingeniería.
- Determine cuál es el PPE adecuado en función del riesgo documentado y de las evaluaciones de peligro de todas las operaciones realizadas en cada mesa. Trate de incorporar los controles de ingeniería e información sobre el PPE en la misma ubicación en todos los manuales de procedimientos, y publique claramente la información de cada operación realizada en la mesa.
- Asegúrese de que los manuales de procedimientos de las estaciones de trabajo incluyan instrucciones para la organización de todos los instrumentos, materiales y suministros en cada área, además de instrucciones para la limpieza y desinfección, y la frecuencia de limpieza y desinfección, de todas las superficies e instrumentos.
- Los supervisores deben inspeccionar rutinariamente la limpieza de la mesa.
- Cuente con procedimientos por escrito para operaciones que no sean del laboratorio, p. ej., mantenimiento de instrumentos técnicos, mantenimiento interno o contratado, respuesta ante emergencias, limpieza del lugar y operaciones de construcción y servicios, a fin de mitigar las exposiciones asociadas con las tareas operativas asignadas.
— Redacte los procedimientos operativos que no sean del laboratorio para los proveedores de servicios externos al laboratorio, junto con sus comentarios y asesoría.
— Documente la capacitación y evalúe la competencia de los proveedores de servicios y operadores de mesa con respecto a todos los procedimientos operativos de mesa escritos que no sean del laboratorio. - Las tinciones bacteriológicas generales pueden constituir un peligro químico o biológico.
— Tinción de Gram. La violeta de genciana, el azul de metileno, el yoduro de potasio y el etanol son irritantes; la violeta de genciana es también carcinogénica y algo tóxica; el etanol es una hepatotoxina.
— Otros riesgos asociados con los procedimientos de la tinción de Gram incluyen la manipulación de organismos vivos, el potencial de crear aerosoles y el potencial de contaminación de la piel y el medio ambiente.
— Se recomienda la protección ocular (gafas de seguridad o gafas para salpicaduras de sustancias químicas) y guantes desechables durante la tinción o su preparación. Los guantes brindan protección contra los organismos vivos mientras se preparan los frotis y ofrecen protección contra la exposición accidental a la tinción.
— Coloque los residuos contaminados en una bolsa de peligro biológico para su desecho. Use las bolsas de peligro biológico una sola vez y luego deséchelas. Nunca las lave ni las vuelva a utilizar.
— Para todas las demás tinciones, incluidos los conjugados fluorescentes, consulte las
Hojas de datos de seguridad de materiales asociadas con cada tinción o sustancia química. - Descontaminación del equipo. Examine el equipo contaminado con sangre u otros materiales potencialmente infecciosos antes de su mantenimiento o envío, y descontamínelo según sea necesario. Comuníquese con el fabricante para consultar el proceso de descontaminación.
- Si no es factible descontaminar un equipo o partes de dicho equipo, haga lo siguiente.
— Rotule el equipo con un símbolo de peligro biológico y un segundo rótulo que identifique específicamente qué partes siguen estando contaminadas.
— Comunique esa información a todos los empleados afectados y representantes de mantenimiento antes de la manipulación, el mantenimiento o el envío, de forma que se tomen las precauciones adecuadas.
3.1.5. Retiro manual de tapas herméticas; obtención de alícuotas de las muestras y transferencia con pipetas
- Siempre retire las tapas detrás de un protector contra salpicaduras fijo a la mesa, o use el PPE adecuado adicional para protegerse de salpicaduras y aerosoles.
- Coloque un paño de gasa sobre la tapa y luego levante o retire la tapa lentamente con un movimiento que la aleje de su cuerpo. Nunca vuelva a utilizar un paño de gasa; esto podría contribuir a la contaminación cruzada. Varios fabricantes comercializan dispositivos de seguridad para ayudar a retirar tapas de tubos y romper ampollas para abrirlas (p. ej., Current Technologies Saf De-Cap [Fisher Health Care, Houston, TX] y Pluggo [LPG Consulting, Inc., Wood River, IL]).
- Use pipetas automáticas y semiautomáticas, y dispositivos de seguridad para transferencia.
3.1.6. Sistemas de tubos neumáticos
- Establezca SOP para el uso y la descontaminación del sistema de tubos neumáticos (pneumatic tube system, PTS).
- La rotura o fuga de muestras transportadas con un PTS implica el riesgo de contaminación del sistema de transporte mismo.
- Base las limitaciones del uso del PTS en una evaluación completa de riesgos y peligros. Limite el tamaño de las muestras, el volumen, el peso y los tipos de recipientes enviados por el sistema de tubos, si es necesario. Esto es de especial importancia en las muestras para citología y ciertos tipos de recipientes para orina.
- Coloque todas las muestras enviadas mediante un PTS en una bolsa con cierre hermético cerrada.
- Pruebe las bolsas y asegúrese de que sean a prueba de fugas en las condiciones del PTS.
- Proteja los formularios de solicitud colocándolos en un bolsillo aparte o adjúntelos en una bolsa secundaria separada para evitar la contaminación.
- Una bolsa con cierre hermético debe contener muestras de un paciente solamente.
- Coloque relleno absorbente entre las bolsas de los pacientes para ayudar a absorber derrames y minimizar la contaminación del exterior del transportador.
- Maneje los transportadores de tubos neumáticos contaminados de acuerdo con las precauciones estándares.
- Desinfecte los transportadores contaminados con una solución de lejía u otro desinfectante siguiendo el protocolo recomendado por el fabricante y aprobado por el comité de control de infecciones del hospital si el sistema está en uso en un hospital.
- Use guantes al abrir transportadores de PTS que contengan muestras de pacientes.
- Descontamine el exterior de los transportadores de tubos antes de llevarlos de nuevo a las áreas de atención de pacientes. Descontamine el interior del transportador si se produce una fuga en un recipiente con muestra.
- Establezca una línea de ayuda del centro para el informe inmediato de problemas con el PTS.
- Establezca un plan de emergencia para el cierre del PTS, que incluya funciones y responsabilidades; incluya la implementación de un plan alternativo de transporte de muestras.
- Desarrolle un sistema para llevar un registro y analizar incidentes o transportadores cerrados incorrectamente, tubos agrietados, tapas flojas y recipientes con fugas. Los aumentos de eventos documentados pueden indicar la necesidad de aclarar o de reforzar las políticas de uso del PTS, o de mejorar las prácticas de recolección de muestras, y podrían identificar transportadores y/o números de lote de recipientes defectuosos.
- Prepare SOP tanto para los operadores del laboratorio como para los proveedores de servicios externos al laboratorio, junto con sus comentarios y asesoría.
- Documente la capacitación y la evaluación de la competencia de los proveedores de servicios y operadores de mesa con respecto al mantenimiento del PTS y los procedimientos de descontaminación. La capacitación y la evaluación de competencias documentadas incluirán el conocimiento de los riesgos asociados con el uso de un PTS y las precauciones que se deben tomar para controlar esos riesgos.
3.2. Precauciones personales.
Si se han implementado controles de ingeniería para evitar salpicaduras o atomizaciones, se puede modificar el requisito del PPE según la evaluación del riesgo y la evidencia de la eficacia del control de ingeniería para evitar la exposición a salpicaduras o atomizaciones. Algunos ejemplos de controles de ingeniería incluyen el uso de un BSC, recipientes o cabezales de seguridad cerrados herméticamente en las centrífugas y flujo de aire negativo hacia el laboratorio.
3.2.1. Trabajo en una mesa abierta
- Debido a que no hay dos estaciones de trabajo idénticas, los procedimientos escritos para cada estación de trabajo de un laboratorio clínico deben incluir prácticas laborales específicas y controles de prácticas laborales para mitigar las posibles exposiciones.
- Instale un lavabo exclusivo para lavarse las manos con agua caliente en cada área de trabajo para usarse después de la contaminación de las manos o los guantes con sangre u otros materiales potencialmente infecciosos. Los empleados no pueden depender solamente de un lavabo en un baño para lavarse las manos después de trabajar en un área técnica. El lavado frecuente de las manos es esencial. Suministre alcohol en gel en cada estación de trabajo para facilitar la limpieza frecuente de las manos, y paños de trabajo absorbentes para contener derrames accidentales. Ponga a disposición de los empleados gafas de seguridad, protector contra salpicaduras, protección respiratoria y guantes para su uso y cuando se determine que es necesario según el tipo de aislado, como se describe en BMBL-5 (1).
- En el laboratorio de microbiología general, las mascarillas y los guantes desechables no son obligatorios en el laboratorio abierto, pero se pueden usar voluntariamente. Si se usan guantes, estos se pueden contaminar fácilmente durante el uso de rutina; por lo tanto, los guantes no se deben lavar y volver a usar. Deseche los guantes y colóquese un par nuevo al dejar la estación de trabajo.
- Se recomienda el uso de protectores contra salpicaduras en las estaciones de trabajo mientras se trabaja en la mesa de hemocultivo o en cualquier estación en la que exista el potencial de salpicaduras.
- Notifique a los trabajadores que estén cerca y al supervisor si se produce una salpicadura o un derrame, independientemente de qué tan pequeños sean.
- Oler cultivos bacterianos cultivados en medios artificiales (para detectar olores característicos que supuestamente emiten ciertas bacterias) es una práctica de laboratorio potencialmente insegura que se ha asociado con múltiples tipos de LAI.
(http://www.cdc.gov/mmwr/preview/mmwrhtml/mm5342a3.htm,
http://www.cdc.gov/mmwr/preview/mmwrhtml/mm5702a2.htm,
http://www.cdc.gov/mmwr/preview/mmwrhtml/mm5702a3.htm, y
http://www.cdc.gov/mmwr/preview/mmwrhtml/mm5532a1.htm)
Los CDC siguen recomendando que oler placas de cultivo debe estar prohibido. Los aislados de bacilos gramnegativos o gramvariables (p. ej., cocobacilos gramnegativos) se deben manipular dentro de un BSC.
- No use mecheros con llama descubierta en ninguna parte del laboratorio. Use asas y agujas desechables o use incineradores eléctricos para dispositivos con cables metálicos.
- Ubique recipientes con desinfectante para residuos y recipientes para objetos cortopunzantes cerca de las estaciones de trabajo.
- Use cubiertas protectoras para los teclados de computadora en las estaciones de trabajo; las cubiertas deben permitir una limpieza fácil y se deben desinfectar de forma rutinaria junto con la superficie de la mesa, como mínimo, al final del turno de trabajo.
- Coloque los frascos de hemocultivos detrás de un protector de seguridad contra salpicaduras o en un BSC al introducirles una aguja. Los cocobacilos gramnegativos de los frascos de hemocultivos se deben manipular dentro de un BSC. Los laboratorios que no tengan la capacidad de determinar o descartar la presencia de Brucella o Francisella (cocobacilos gramnegativos) deben considerar el envío directo de esos aislados a un laboratorio de referencia y no intentar aislarlos o identificarlos.
- La orina que sobra de las actividades de cultivo se puede desechar por el desagüe del lavabo o en una alcantarilla sanitaria.
- Deseche las heces y otras muestras, como fluidos corporales y muestras respiratorias, que sobren de actividades de cultivo con los residuos médicos, y esterilice en autoclave si la evaluación de riesgos así lo requiere.
- Deseche los tejidos que sobren de actividades de cultivo de agentes infecciosos BSL-3 con los residuos médicos y esterilice en autoclave.
3.2.2. Equipo de protección personal
Los controles de ingeniería (2.1.5. Paso 5) siempre deben ser la primera línea de defensa para minimizar las exposiciones.
El PPE incluye diversos elementos, como guantes, delantales de laboratorio, batas, protectores de calzado, botas, mascarillas, protectores faciales, gafas de seguridad y gafas especiales, que están diseñados para proteger al trabajador de un laboratorio de la exposición a peligros físicos, biológicos y químicos. Distribuir PPE a todos los empleados según sea necesario ayuda a garantizar el acceso al PPE adecuado.
El PPE se utiliza a menudo en combinación con BSC y otros dispositivos que permiten la contención de los agentes o materiales que se manipulan. En algunas situaciones en las que el trabajo en un BSC es impráctico, el PPE, incluidos los protectores contra salpicaduras, puede formar la barrera primaria entre el personal y los materiales peligrosos (1). (Consulte la Sección 3.1).
La Administración de Seguridad y Salud Ocupacionales (OSHA) define al PPE como “adecuado” si este no permite el paso de la sangre u otros materiales potencialmente infecciosos o el contacto de estos con la ropa de calle del empleado, la ropa interior, la piel, los ojos, la boca ni las membranas mucosas en condiciones normales de uso (33).
- Fuentes para los estándares relativos al PPE
— Sociedad Estadounidense de Análisis y Materiales (American Society for Testing and Materials, ASTM, que ahora se conoce como ASTM Internacional): delantales de laboratorio, protección de las manos (guantes desechables)
— Instituto Estadounidense de Estándares Nacionales (American National Standards Institute, ANSI) Z87.1-2003 (o estándares consensuados anteriores del ANSI) (Estándar de EE. UU. para la protección ocular y facial ocupacional y educativa): protección de los ojos y la cara.
— Administración de Drogas y Alimentos (Food and Drug Administration, FDA): protección de las manos (guantes).
— OSHA: uso adecuado del PPE, protección de las manos, capacitación de los empleados. - Delantales de laboratorio
— Se recomienda el uso de delantales, batas o uniformes de laboratorio para evitar la contaminación de la ropa personal. Quítese la ropa protectora antes de ir a áreas externas al laboratorio (p. ej., cafetería, sala de descanso, oficinas administrativas). Deseche la ropa protectora de un solo uso junto con otros residuos contaminados o deposite la ropa reutilizable para que la institución se encargue de su lavado.
— No lleve la ropa de laboratorio y otro PPE a su casa para el lavado u otros usos. El empleador debe prestar el servicio de lavandería para los delantales, las batas, los uniformes o las prendas protectoras de laboratorio reutilizables que estén potencial o visiblemente contaminadas con sangre u otros materiales potencialmente infecciosos sin costo para el empleado. - Protección de las manos
— No hay ningún estándar del ANSI relativo a los guantes, pero los estándares de la ASTM relativos a guantes desechables se basan en el tipo específico de material del que está hecho el guante. La FDA ha indicado que los guantes para el examen de pacientes usados durante la atención de los pacientes y los procedimientos de acceso vascular cumplen con sus requisitos de adulteración y tienen un registro de dispositivo médico de 510(k) en ese organismo. La OSHA recomienda que la selección se base en las tareas realizadas y en las características de rendimiento y construcción del material del guante. Los guantes desechables deben estar disponibles en diversos tamaños para asegurarse de que los empleados puedan seleccionar el tamaño que sea mejor para sus manos. Proporcione guantes desechables hechos de distintos materiales (p. ej., nitrilo, cloropreno) para los empleados que tienen sensibilidad cutánea al tipo de material del guante o a los aceleradores u otras sustancias químicas usadas en el proceso de fabricación de los guantes.
— Evalúe los antecedentes médicos de los empleados para ver si hay evidencia de alergia al látex si se usan guantes de látex en el laboratorio.
— Basándose en la evaluación del peligro para una operación determinada, la gerencia del laboratorio o un empleado de seguridad o un equipo de seguridad asignado deben seleccionar el guante más adecuado para la tarea y establecer durante cuánto tiempo se puede usar.
— Antes de comprar guantes, la gerencia del laboratorio o un empleado de seguridad o un equipo de seguridad asignado deben solicitar documentación al fabricante que indique que los guantes cumplen con los estándares de prueba correspondientes para los peligros previstos. - Protección facial y ocular
— La protección ocular y facial (gafas, mascarilla, protector facial u otro protector contra salpicaduras) se debe usar siempre que se pueda producir una salpicadura o una atomización. Esto incluye la apertura de recipientes y la transferencia con pipetas, la manipulación, la obtención de alícuotas o el análisis de muestras, cultivos, agentes biológicos u otros materiales peligrosos fuera de un BSC.
— Si se contamina la protección ocular y facial, esos dispositivos se deben descontaminar antes de volver a usarlos, o se deben desechar con otros residuos de laboratorio contaminados.
— Ni los lentes de lectura ni los lentes de contacto se consideran PPE. Los trabajadores de laboratorio que usen lentes de contacto deben usar protección facial como se describe arriba. Aquellos que necesiten corrección para la visión deben usar lentes de seguridad graduados con protectores laterales en el laboratorio. En caso de salpicadura química, los lentes de contacto pueden intensificar el daño porque los lentes retendrán la sustancia química contra el ojo durante un periodo más largo.
— Las mascarillas quirúrgicas no son PPE respiratorio. - Capacitación de los empleados
— La OSHA exige que los empleadores capaciten a los empleados para que sepan al menos lo siguiente (37).-
Cuándo es necesario usar PPE
-
Qué PPE es necesario
-
Cómo colocarse, quitarse, ajustar y usar el PPE adecuadamente
-
Limitaciones del PPE
-
El cuidado adecuado, el mantenimiento, la vida útil y el desecho del PPE
-
3.3. Gabinete de seguridad biológica
- Los BSC clase II-A1 o II-A2 son los más adecuados y recomendados para el laboratorio de diagnóstico (Tabla 5) (1). En el Apéndice A de BMBL-5 se encuentra una descripción general y un resumen de las distintas clases y tipos de BSC (1).
- Todos los laboratorios de diagnóstico de microbiología necesitan uno o más BSC como medio primario de contención para trabajar en forma segura con organismos infecciosos. El Colegio de Patólogos de Estados Unidos requiere un BSC en el laboratorio de microbiología. La ausencia de un BSC es una deficiencia de fase II para los departamentos de microbiología que manipulan muestras u organismos considerados contagiosos y de transmisión mediante el aire. Los tres tipos básicos de BSC se designan como clase I, clase II y clase III.
— El gabinete clase I es similar a una campana de extracción de gases químicos, y por lo general, consiste en un conducto rígido hacia el sistema de extracción del edificio. Protege al personal y el ambiente de la sala, pero no está diseñado para proteger al producto que está dentro del gabinete. El BSC clase I se podría usar en el área general de preparación del laboratorio como segunda opción de gabinete.
— En la mayoría de los laboratorios de diagnóstico en los que no se manipularán sustancias químicas volátiles ni toxinas dentro del gabinete, un BSC clase II-A2 sería adecuado y más fácil de instalar sin un conducto rígido hacia el exterior. Este gabinete se puede usar en la estación de procesamiento de muestras; en los laboratorios de micobacteriología, micología y virología, y en química y hematología, si es necesario. El aire puede volver a circular hacia la sala a través de filtros de aire particulado de alta eficiencia (high-efficiency particulate air, HEPA) con escaso riesgo si el gabinete tiene un mantenimiento adecuado y se certifica anualmente. El BSC A-1 o A-2 en el laboratorio de micobacteriología también es una opción con una conexión por medio de un capuchón pequeño a un conducto de extracción del edificio y con certificación anual. El BSC clase A nunca se debe conectar al sistema de extracción del edificio mediante un conducto rígido, ya que los patrones del flujo de aire del edificio no se pueden igualar con los del gabinete. Los filtros HEPA eliminan al menos el 99,97 % de las partículas de 0,3 µm, lo que incluye todas las bacterias, virus y esporas y partículas o gotitas que contienen esos organismos.
— El gabinete clase III está diseñado para agentes muy infecciosos, como el virus Ébola y el virus de la viruela de los monos. - Todos los BSC deben ser certificados por profesionales capacitados de acuerdo con el Anexo F del ANSI/estándar n.º 49 de NSF, por lo menos una vez al año y cada vez que se mueva la unidad. Mover el gabinete puede dañar el filtro en la unión o la junta, provocando fugas peligrosas, de modo que la integridad del filtro y del gabinete se deben verificar después de cada movimiento.
- La carga adecuada del BSC y el acceso apropiado por parte del personal de laboratorio se describen en BMBL-5. Es importante resaltar algunas reglas básicas.
— No saque los brazos ni los introduzca de forma brusca al gabinete. Introduzca y saque los brazos lentamente, perpendiculares a la abertura para la cara.
— Instale el BSC en el laboratorio lejos de las áreas de paso, ventiladores y puertas de la sala.
— No bloquee la parrilla frontal hacia donde se dirige el flujo descendente de aire, ni la parrilla trasera, donde se elimina el aire del gabinete.
— Deje los extractores funcionando durante al menos 4 minutos antes de empezar a trabajar para permitir la “purga” del gabinete.
— Al inicio y al final del día, con el extractor en marcha, desinfecte todas las superficies con una dilución 1:10 de lejía doméstica y retire los residuos de lejía con alcohol al 70 %, o use otro desinfectante adecuado para los organismos encontrados.
— No use llamas descubiertas dentro del gabinete. Primera elección: asas desechables; segunda opción: hornos eléctricos.
— Para descontaminar el BSC antes del mantenimiento, contrate a un técnico certificado en BSC que use gas formaldehído, vapor de peróxido de hidrógeno o gas dióxido de cloro cuando el BSC no esté funcionando.
— Las lámparas ultravioletas (UV) no son obligatorias en los BSC y no son necesarias.
— Abra los rotores sellados o los recipientes de seguridad de las centrífugas de alta velocidad y las ultracentrífugas en un BSC, en especial al manipular patógenos respiratorios.
— Cuando no sea posible usar recipientes de seguridad o rotores sellados, coloque las centrífugas en un dispositivo de contención o en un BSC diseñado para ese fin.
— Recolecte los residuos médicos generados en el BSC en bolsas o recipientes para objetos cortopunzantes. Ciérrelos herméticamente y colóquelos en recipientes para residuos médicos fuera del BSC. - Si una persona que trabaja en un BSC tiene una infección que posiblemente haya involucrado material manipulado en el gabinete, como una prueba cutánea de conversión de tuberculina o un resultado positivo de un ensayo de TB de liberación de interferón gamma en una persona que trabaja con Mycobacterium tuberculosis, se debe realizar una evaluación que incluya:
— evaluación y, según sea necesario, reparación y recertificación de los BSC en los que se realizó el trabajo implicado;
— evaluación de los procedimientos para asegurarse de que el trabajador estuviera usando la técnica adecuada en el BSC y, si es necesario, repetición de las instrucciones para el trabajador acerca de la técnica adecuada para el BSC; y
— evaluación (p. ej., prueba cutánea de tuberculina) de otras personas del laboratorio que trabajen en los mismos BSC y, según sea necesario, repetición de las instrucciones para esas personas acerca de la técnica adecuada para el BSC.
3.4. Desinfección
3.4.1. Buenas prácticas laborales
- Independientemente del método, el propósito de la descontaminación es proteger al empleado de laboratorio, al ambiente y a cualquier persona que ingrese al laboratorio o que manipule materiales del laboratorio que se hayan sacado del mismo. Para obtener información detallada, consulte el Apéndice A de BMBL-5 (1).
- Las instrucciones para desinfectar una mesa de trabajo de laboratorio deben formar parte de cada SOP y deben incluir qué PPE usar, cómo limpiar las superficies, qué desinfectante usar y cómo desechar los materiales de limpieza. El tiempo de contacto es una parte fundamental y necesaria de las instrucciones. Coloque un cartel con las instrucciones en el área de la mesa para consultarlas fácilmente.
- Limpie de forma rutinaria las superficies ambientales antes de preparar áreas de trabajo y vuelva a limpiarlas antes de dejar las áreas de trabajo.
- Limpie cualquier objeto (p. ej., temporizador, pluma, teléfono, termómetro) que se haya tocado con guantes usados.
- No use alcoholes ni soluciones a base de alcohol solas para desinfectar áreas de superficie. Estos productos se evaporan rápidamente, lo que disminuye su eficacia en gran medida. Use desinfectantes recomendados para superficies ambientales, como los desinfectantes registrados en la Agencia de Protección Ambiental (Environmental Protection Agency, EPA) que son eficaces contra el virus de la hepatitis B, el VIH y otros patógenos transmitidos mediante la sangre, o bien use una dilución 1:10 de lejía doméstica. La información sobre el registro de productos desinfectantes ambientales de la EPA está disponible en http://www.epa.gov/oppad001/chemregindex.htm.
- Reserve los esterilizantes y desinfectantes de alto nivel autorizados por la FDA para procesar dispositivos médicos reutilizables. La FDA ha identificado fabricantes, principios activos y condiciones de contacto para estos productos. Las listas de esterilizantes y desinfectantes de alto nivel autorizados por la FDA están disponibles en http://www.fda.gov/cdrh/ode/germlab.html.
- Limpie las superficies de mesas, estantes fijos, baldosas, agitadores, soportes para tinción de portaobjetos, baños de agua/baños calentadores y todas las bandejas siempre que haya un derrame. Limpie todas las superficies al final de cada turno.
- El uso de fundas desechables puede reducir los intervalos de limpieza del equipo, pero no reemplaza la necesidad de limpiar las áreas de superficie o el equipo. Limpie la superficie de la mesa que estaba protegida con la funda cada vez que la deseche. La funda debe ser desinfectada o desechada al final de cada turno o si está contaminada.
- Existen fundas para superficies disponibles comercialmente, desechables, flexibles, con fondo de película de polietileno, antideslizantes y muy absorbentes, que ayudan a prevenir el traspaso de la mayoría de las soluciones, incluidos los tintes y las sustancias químicas corrosivas. Siempre deseche los residuos médicos después de una contaminación y al final del turno.
- Deje la sangre o los fluidos corporales secos en contacto con la solución descontaminante especificada para el laboratorio durante al menos 20 minutos para permitir su penetración y fácil eliminación (1). Nunca use un cuchillo ni otro instrumento para raspar la sangre o los fluidos corporales secos de áreas de superficie; esto puede producir una lesión percutánea o generar aerosoles.
3.4.2. Soluciones de lejía (hipoclorito de sodio) (38)
- Las soluciones de hipoclorito están clasificadas como irritantes y corrosivas. Una solución de lejía sin diluir es corrosiva para el acero inoxidable, y después de utilizarla en un BSC y en lavabos de acero inoxidable, se debe enjuagar minuciosamente para eliminar el residuo. No esterilice las soluciones de lejía en el autoclave.
- Nunca mezcle distintas soluciones de cloro, ni las guarde con productos de limpieza que contengan amoníaco, cloruro de amonio o ácido fosfórico. Combinar esas sustancias químicas podría provocar la liberación de gas cloruro, que puede producir náuseas, irritación ocular, lagrimeo, dolor de cabeza y falta de aire. Esos síntomas pueden durar varias horas. Un trabajador expuesto a un olor fuerte y desagradable después de mezclar una solución de cloro con un producto de limpieza debe abandonar la sala o el área de inmediato y permanecer fuera del área hasta que los gases hayan desaparecido por completo (consulte la Sección 9.1).
- Para que sean desinfectantes eficaces, las soluciones de trabajo de lejía deben contener > 0,5 % pero < 2 % de hipoclorito de sodio. La concentración de hipoclorito en la lejía doméstica varía según el fabricante. Muchas soluciones de lejía doméstica contienen 5,25 % de hipoclorito de sodio, y una dilución 1:10 (5.000 ppm Cl) producirá una solución de hipoclorito al 0,53 %. El uso de soluciones de lejía con concentraciones menores de hipoclorito podría no aportar el nivel de desinfección adecuado. Prepare una solución nueva de lejía doméstica de 1:10 todos los días.
3.5. Gestión de residuos
Un laboratorio clínico debe establecer un plan de gestión de residuos.
- Como parte de un plan de gestión de residuos en el lugar, las responsabilidades de la gerencia del laboratorio o del empleado de seguridad o del equipo de seguridad designados son:
— establecer un programa de reducción o minimización de residuos;
— identificar y definir todas las categorías de residuos generados por el laboratorio;
— por cada categoría de desecho generado, determinar la aplicabilidad de reglamentaciones federales, estatales y locales, lo que incluye cómo se va a separar, acondicionar, rotular/codificar por color, almacenar, transportar y hacer el seguimiento de esa categoría de residuos en el laboratorio, fuera del laboratorio y fuera del centro para cumplir con las reglamentaciones aplicables;
— separar todos los residuos regulados a fin de impedir que el público o los clientes accedan a ellos;
— establecer un sistema para informar y responder a todas las cuestiones o problemas relativos a la gestión de residuos médicos y
— establecer procesos de tratamiento y eliminación (39). La eliminación de residuos regulados debe estar a cargo de una compañía que cumpla con los requisitos de autorización estatales y locales.
3.5.1. Descontaminación de residuos médicos antes de su traslado y eliminación
- Los “residuos médicos infecciosos” se definen como residuos que pueden transmitir enfermedades. Los “residuos médicos regulados” son cualquier residuo contaminado que tenga cantidades considerables de sangre o hemoderivados en forma líquida o semilíquida, o que tenga objetos cortopunzantes contaminados. Se considera que tienen un mayor nivel de riesgo, por lo que exigen la aplicación de disposiciones reguladoras por parte de las autoridades estatales o locales.
- Los laboratorios clínicos deben determinar qué leyes federales, estatales y locales rigen los residuos médicos regulados de sus organizaciones y deben asegurarse de que la organización cumpla esas leyes. Las regulaciones locales y/o estatales pueden requerir
— permisos o números de registro para generar residuos médicos;
— elaboración e implementación de un plan de gestión de residuos y/o
— cumplimiento de conservación de registros específicos. - Los departamentos estatales de servicios ambientales (o equivalentes) son un excelente recurso para solicitar ayuda para cumplir con las leyes estatales y locales relativas a los residuos médicos. Para ver las leyes que rigen los residuos médicos, visite http://www.epa.gov/epawaste/nonhaz/industrial/medical/programs.htm. Seleccione el estado y luego busque en “Materiales primarios: cajas, códigos y reglamentaciones” (Primary Materials–Cases, Codes and Regulations). Busque los “Códigos administrativos” o “Estatutos” para ver información sobre la gestión de residuos. (En algunos estados, se usan otros términos para “residuos médicos infecciosos”, como “residuos médicos regulados” o “residuos especiales”.)
- OSHA. En 29 CFR Parte 1910.1030, Exposición ocupacional a patógenos transmitidos por sangre, se proporcionan los requisitos mínimos para rotular y acondicionar la sangre y los hemoderivados para su transporte fuera de un laboratorio. La información está disponible a través de la oficina local de la OSHA o en Internet (33).
- La gerencia del laboratorio debe asegurarse de que los empleados comprendan esas leyes y garantizar que los residuos médicos regulados no se mezclen con los residuos no médicos de un centro.
- Documente la realización de capacitación de los empleados y la evaluación de competencia para
— construir y rotular adecuadamente recipientes para residuos médicos que deban ensamblarse antes del uso;
— desecho de residuos médicos en recipientes rotulados adecuadamente;
— uso de suministros apropiados, p. ej., recipientes, bolsas de plástico apropiadas, etiquetas; y
— cumplimiento de todas las reglamentaciones federales, estatales y locales relativas a la gestión de residuos, p. ej., manipulación de residuos médicos, desecho inmediato de residuos médicos, almacenamiento de residuos médicos, transporte de residuos médicos, lo que incluye cualquier etiqueta que exija el Departamento de Transporte (p. ej., las palabras “Peligro biológico” y el símbolo universal de peligro biológico) en los recipientes para traslado y la eliminación final de los residuos médicos.
3.5.2. Gestión de cultivos y existencias desechados
- Debe considerarse el nivel de bioseguridad del laboratorio al desechar cultivos y existencias de agentes infecciosos.
- Los cultivos y existencias de organismos desechados gestionados conforme a la contención física de BSL-3 (p. ej., M. tuberculosis) se deben recolectar y sellar en recipientes cerrados, a prueba de fugas, y se les debe colocar el símbolo universal de peligro biológico y las palabras “Peligro biológico”. Posteriormente, los recipientes se deben esterilizar en el autoclave del sitio. Se puede considerar el uso de otras tecnologías de tratamiento de residuos médicos si estas esterilizan los organismos, si fueron validadas adecuadamente y si están reconocidas como tecnologías de tratamiento de residuos médicos por el organismo de regulación ambiental estatal pertinente.
- Descontamine los cultivos y existencias de organismos desechados utilizados en BSL-2. Si este proceso se realiza en el sitio, pero lejos del departamento de microbiología, coloque los cultivos y existencias desechados en recipientes durables a prueba de fugas que sean seguros al transportarlos. La descontaminación se puede hacer en un centro contratado de tratamiento de residuos médicos si los residuos se colocan en recipientes para envío de residuos médicos y se acondicionan de acuerdo con los estándares de regulación aplicables. Para determinar si se pueden realizar esas actividades de forma tal que se minimicen las posibles exposiciones, realice una evaluación de riesgos. La evaluación determinará si esos residuos se pueden tratar de forma segura fuera del sitio o si deben ser tratados en el sitio.
3.5.3. Desechar un agente seleccionado
- Existen reglamentaciones (7 CFR 331, 9 CFR 121 y 42 CFR 73) que exigen que los laboratorios clínicos o de diagnóstico y otras entidades que hayan identificado agentes o toxinas seleccionados presentes en una muestra entregada para diagnóstico o verificación informen la identificación en un plazo de 7 días calendario al Servicio de Inspección de Animales y Plantas (Animal and Plant Health Inspection Service, APHIS) del Departamento de Agricultura de los EE. UU. o a los CDC. Además, esos laboratorios o entidades deben informar la identificación de agentes y toxinas seleccionados hallados en muestras recibidas para análisis de aptitud en un plazo de 90 días desde la recepción de la muestra.
- El desecho de cultivos que contengan agentes seleccionados identificados, como Brucella spp., Coccidioides immitis o Yersinia pestis, ya sea que se los haya identificado en el centro local o en un laboratorio de referencia, está regulado por la Norma de agentes seleccionados (Select Agent Rule) (40). Los laboratorios clínicos o de diagnóstico y otras entidades emplean el formulario 4 de APHIS/CDC, “Report of the Identification of a Select Agent or Toxin” (Informe de identificación de un agente o toxina seleccionado) para notificar al APHIS o a los CDC acerca de la identificación de un agente o toxina seleccionado como consecuencia de un análisis de diagnóstico, verificación o aptitud, y de la eliminación final de dicho agente o toxina. No se requieren más informes si el aislado se destruye en un plazo de 7 días después de su identificación o se envía a un laboratorio registrado y se notifica a los CDC acerca de la eliminación del aislamiento.
- Un agente o toxina seleccionado se puede destruir en el lugar mediante autoclave. Si el centro utiliza una compañía contratada para los residuos médicos, los cultivos que contienen el agente o toxina identificado se deben inactivar primero dejándolos sumergidos por completo durante la noche en recipientes abiertos para cultivo, en una solución 1:10 de lejía recién preparada, antes de desecharlos con los residuos médicos. Si la compañía para residuos médicos contratada está registrada en el Programa de agentes seleccionados, los cultivos vivos se pueden transferir formalmente a la compañía mediante el formulario 2 de APHIS/CDC, “Request to Transfer Select Agents and Toxins” (Solicitud para transferir agentes y toxinas seleccionados). Los detalles de la norma de agentes seleccionados y su impacto en los laboratorios clínicos se hallan en el Boletín de microbiología clínica (Clinical Microbiology Newsletter), 15 de abril de 2006 (41).
3.5.4. Seguridad del autoclave
- Los esterilizadores a vapor por desplazamiento de gravedad (autoclaves) con frecuencia se utilizan en los laboratorios de microbiología (incluidos los de virología). Las autoclaves generan calor y presión considerables, y todos los usuarios deben comprender y respetar los riesgos asociados.
- El personal que opera el autoclave se debe capacitar para acondicionar, cargar y rotular los materiales que se colocarán en el autoclave de acuerdo con los procedimientos usados para validar el ciclo de esterilización de la unidad. También se deben capacitar en materia de procedimientos de emergencia.
- No toque los lados o la parte trasera de los autoclaves más viejos; su protección térmica es escasa o nula y pueden provocar quemaduras.
- No apile ni guarde materiales combustibles (p. ej., cartón, materiales plásticos) ni líquidos inflamables cerca del autoclave.
- Nunca coloque en el autoclave materiales que contengan agentes tóxicos, corrosivos (p. ej., ácidos, bases, fenol), solventes o volátiles (p. ej., etanol, metanol, acetona, cloroformo), ni materiales radioactivos.
- Coloque todos los residuos biomédicos que descontaminará en el autoclave en una bolsa para autoclave aprobada con rótulo de peligro biológico antes de usar el autoclave. No todas las bolsas rojas o naranjas se pueden usar en el autoclave. Las bolsas seleccionadas para usar con residuos sometidos a autoclave deben estar fabricadas específicamente para ese propósito. Use solamente las bolsas designadas como adecuadas para usarse en autoclaves cuando someta residuos médicos al autoclave.
- Coloque todos los objetos cortopunzantes (p. ej., agujas, escalpelos, pipetas o vidrio roto) en un recipiente para objetos cortopunzantes rígido, aprobado, resistente a fugas y etiquetado antes de la esterilización.
- Al descontaminar una bolsa de materiales secos, como papel de mesa o batas de papel, coloque 100 ml de agua en el autoclave para facilitar la producción de vapor dentro de la bolsa.
- No llene las bolsas o la unidad del autoclave en exceso; esto podría producir una circulación inadecuada de vapor, lo que podría interferir con el proceso de esterilización.
- Cierre las bolsas para autoclave sin apretar, con un alambre de color u otro medio que permita el ingreso del vapor en su interior.
- Coloque las bolsas en bandejas de acero inoxidable o polipropileno para introducirlas en el autoclave. No coloque las bolsas directamente en el autoclave.
- Espere siempre a que la unidad del autoclave se enfríe antes de abrirla. Apártese y abra la puerta lentamente para que salga el exceso de vapor. Deje que el contenido se enfríe antes de manipularlo. Use siempre guantes gruesos, hasta el codo, resistentes al calor e impermeables para retirar los artículos calientes del autoclave.
- Después de usar el autoclave, verifique la cinta del indicador para asegurarse de que las barras sean negras. Si la cinta del indicador no está activada, vuelva a esterilizar la carga.
- Al menos una vez por semana, use un indicador biológico, como tiras con esporas de Bacillus stearothermophilus (o un equivalente) para asegurarse de que el autoclave esté funcionando correctamente. Establezca y siga un cronograma de mantenimiento rutinario para este equipo, en el que se evalúen los sellos, drenajes y demás aspectos fundamentales.
3.6. Hielo seco
3.6.1. Información general
En ciertas circunstancias, el hielo seco puede suponer un peligro de explosión. El hielo seco es dióxido de carbono (CO) solidificado y es extremadamente frío (-79 °C [-109 °F]). A diferencia del agua congelada, el hielo seco se sublima (cambia directamente de sólido a gas) a medida que se calienta y libera CO. El vapor de CO es considerablemente más pesado que el aire; en espacios cerrados mal ventilados, puede desplazar al aire y provocar asfixia.
- Evite el contacto entre el hielo seco y la piel o los ojos. El hielo seco puede provocar quemaduras graves por congelación a los pocos segundos de contacto directo.
- Nunca coloque hielo seco en recipientes de vidrio o cerrados herméticamente. Guardarlo en un recipiente cerrado herméticamente puede provocar que este se rompa o explote por exceso de presión.
- Nunca manipule el hielo seco con las manos sin protección. Use siempre guantes aislantes y gafas de seguridad. También se recomienda el uso de delantales de laboratorio. Utilice pinzas para manipular bloques de hielo seco. Use cucharas para mover hielo seco peletizado.
- No lleve hielo seco a la boca ni lo ingiera de ninguna otra manera. Si se ingiere, el hielo seco puede provocar una lesión interna grave. Nunca coloque hielo seco en bebidas para enfriarlas.
- Al transportar hielo seco, coloque el recipiente en el maletero del auto o la plataforma del camión, y deje las ventanas del vehículo abiertas para que circule aire fresco. Nunca deje hielo seco en un vehículo con pasajeros estacionado. La sublimación del hielo seco en un vehículo con pasajeros cerrado puede llevar a la acumulación de concentraciones peligrosas de vapor de CO asfixiante. Al abrir un área de carga cerrada que contenga hielo seco, deje que el espacio cerrado se ventile durante 5 minutos antes de entrar.
- No coloque hielo seco directamente sobre la superficie de mesas, azulejos, superficies laminadas o lavabos de cerámica. Use una barrera aislante, como un cartón de doble grosor o madera. El hielo seco puede destruir el agente adhesivo que sostiene los azulejos o el material laminado. El hielo seco también puede agrietar las superficies de mesas y lavabos de cerámica.
3.6.2. Cómo desechar hielo seco
- Deje que el hielo seco se sublime o evapore hacia la atmósfera en un área bien ventilada en la que no se pueda acumular el vapor de CO.
- No deseche el hielo seco en alcantarillas, lavabos o inodoros. El frío extremo puede fracturar los sanitarios de cerámica o agrietar las cañerías de cloruro de polivinilo (PVC). Si se arroja al inodoro e ingresa a la cañería de agua, la acumulación de gas puede provocar una explosión.
- No coloque hielo seco en cestos de basura o recipientes similares. El frío extremo y la condensación resultante pueden destruir esos receptáculos.
3.7. Seguridad eléctrica
- Los peligros eléctricos se pueden categorizar en dos tipos principales: los que pueden producir una descarga eléctrica y los que pueden producir incendios y/o explosiones.
- Las descargas eléctricas se pueden evitar asegurándose de que los equipos y los cables eléctricos estén en buen estado, de que se usen tomacorrientes con conexión a tierra y de que se usen tomas con interrupción por falla de la conexión a tierra o disyuntores cerca de lavabos, estaciones de lavado de ojos, duchas de emergencia u otras fuentes de agua.
- No sobrecargue los circuitos eléctricos. Minimice o elimine el uso de regletas de alimentación con múltiples tomas. Cuando sea necesario usar regletas de alimentación, la oficina de seguridad del centro o un electricista matriculado debe aprobar su uso.
- Desconecte de la fuente el equipo conectado a fuentes de alimentación de alto voltaje o alto amperaje o incluya un dispositivo de bloqueo en la caja del disyuntor para evitar la activación del circuito antes de realizar el mantenimiento.
- Dado que los dispositivos eléctricos pueden producir chispas, no los use cerca de gases o líquidos inflamables o volátiles.
- Nunca coloque líquidos inflamables en un refrigerador doméstico. La chispa que genera la llave de luz activada con la puerta puede encender gases atrapados en la unidad y provocar una explosión y un incendio.
- Se deben usar refrigeradores especializados al guardar sustancias químicas con potencial de explosión.
3.8. Gases en el laboratorio: Cilindros de gas comprimido
A menudo se utilizan cilindros de CO comprimido para suministrar gases para incubadoras de CO; los riesgos asociados con esas incubadoras son mínimos siempre y cuando la habitación esté bien ventilada.
3.8.1. Peligros
- Los cilindros de gas implican tres peligros importantes para la seguridad:
— Los cilindros de gas son pesados y, por lo tanto, un cilindro que se cae puede provocar una lesión.
— La válvula conectada al cilindro es relativamente frágil en comparación con el cilindro; si la válvula se rompe, el cilindro puede convertirse en un proyectil peligroso.
— Las válvulas o reguladores defectuosos pueden tener fugas y dejar escapar gases tóxicos o inflamables en la habitación. - En el laboratorio de microscopia electrónica, se utiliza nitrógeno para llevar las cámaras de vacío a la presión atmosférica, y los secadores de punto crítico utilizan CO como fluido de transición en el proceso de secado para escanear las muestras para microscopia electrónica.
- En los recubrimientos con atomización se utiliza argón y, en algunos laboratorios, se realiza incineración de plasma de muestras biológicas, para lo que se necesita oxígeno (42).
3.8.2. Cómo minimizar los peligros
Muchos de estos peligros potenciales se pueden minimizar adoptando prácticas de manipulación seguras.
- Los cilindros deben estar fijados a la pared en forma segura con cadenas o correas para impedir que se caigan. Los cilindros < 46 cm (18 pulgadas) de alto se pueden asegurar en soportes aprobados o en soportes de pared.
- Al instalar un cilindro nuevo, deje la tapa de la válvula protectora colocada hasta que el cilindro esté asegurado. Reemplace la tapa de la válvula protectora antes de retirar las correas o las cadenas del cilindro.
- Para cada tipo de gas se han diseñado reguladores y roscas especiales. No trate de forzar las roscas o usar el regulador incorrecto en un tanque.
- Los reguladores normalmente se suministran con instrucciones para el mantenimiento de rutina y la verificación periódica para garantizar un funcionamiento seguro. Siga esas instrucciones y controles estrictamente.
- Use siempre carros diseñados especialmente para el transporte de los cilindros. Los cilindros deben estar fijados al carro y los protectores de las válvulas deben estar colocados al mover los cilindros. No se deben arrastrar, hacer girar ni transportar a mano. No levante los cilindros por la tapa.
3.9. Gases líquidos (criogénicos)
Los líquidos criogénicos son gases licuados que tienen un punto de ebullición normal inferior a -150 °C (-238 °F). El nitrógeno líquido se usa en el laboratorio de microbiología para congelar y preservar células y existencias de virus. En el laboratorio de microscopia electrónica, en las salas de cortes congelados y de macroscopia para patología quirúrgica suele usarse nitrógeno líquido; en algunos laboratorios también se usa helio líquido. Los principales peligros asociados con la manipulación de líquidos criogénicos incluyen quemaduras de contacto por frío y congelación, asfixia, explosión y fragilización de los materiales.
3.9.1. Quemaduras de contacto por frío y congelación
- El nitrógeno líquido es peligrosamente frío (-196 °C [-320 °F]), y el contacto de la piel con la fase líquida o gaseosa puede producir una quemadura por congelación de inmediato. A -268 °C (-450 °F), el helio líquido es peligroso y lo suficientemente frío como para solidificar el aire atmosférico.
- Use siempre protección en los ojos (protector facial sobre gafas de seguridad). Los ojos son extremadamente sensibles a la congelación, y el nitrógeno líquido o los vapores de nitrógeno líquido pueden causar daño ocular.
- Evite el contacto de la piel no protegida con cañerías, mangueras, pinzas, rociadores, soportes para almacenamiento de muestras u otros objetos de metal, porque estos se enfrían extremadamente cuando se exponen a nitrógeno líquido. La piel se quedará pegada al metal y se desgarrarán los tejidos al intentar despegarla.
- Al llenar recipientes Dewar criogénicos, use camisas o delantales de laboratorio de mangas largas, pantalones largos (preferentemente, sin dobladillos que puedan almacenar líquido), calzado cerrado (nunca sandalias ni zapatos abiertos) y crioguantes aislantes rotulados como apropiados para usar con líquidos criogénicos. No meta las perneras del pantalón en los zapatos o botas; esto podría dirigir el líquido hacia la cobertura de los pies y atrapar el líquido criogénico contra la piel.
- Use guantes térmicos sueltos con puños hasta el codo al llenar recipientes Dewar criogénicos. Asegúrese de que los guantes sean lo bastante sueltos para poder quitárselos rápidamente si entran en contacto con el líquido.
- Nunca coloque las manos con guantes en el nitrógeno líquido ni en el chorro de nitrógeno líquido mientras llena un recipiente Dewar criogénico. Los guantes no están calificados para este tipo de exposición. Los guantes aislantes están diseñados para brindar protección a corto plazo durante la manipulación de mangueras o dispensadores y durante el contacto accidental con el líquido. Use pinzas especiales para líquidos criogénicos al sacar objetos del nitrógeno líquido.
- El nitrógeno líquido conlleva un alto riesgo de salpicaduras; se pueden generar chorros de nitrógeno líquido al colocar en él bastones, latas u otros objetos que están a temperaturas mucho más altas. Esas actividades pueden implicar peligro de congelación.
- No inserte un tubo hueco en el nitrógeno líquido, ya que puede salir un chorro de gas licuado del tubo.
3.9.2. Peligro de asfixia
- Si bien el nitrógeno es no tóxico e inerte, puede actuar como asfixiante al desplazar el oxígeno del aire a niveles inferiores a los necesarios para mantener la vida. La inhalación de nitrógeno en cantidades excesivas puede provocar mareos, náuseas, vómitos, pérdida de la conciencia y muerte sin advertencias.
- Cuando se expulsan líquidos criogénicos a la atmósfera a temperatura ambiente, estos se evaporan y se expanden a 700–800 veces su volumen en forma líquida. Incluso pequeñas cantidades de líquido pueden desplazar grandes cantidades de oxígeno gaseoso y disminuir el contenido de oxígeno atmosférico a niveles inferiores a los seguros (23,38,42,43).
- No guarde recipientes Dewar criogénicos en un espacio cerrado. El gas de ventilación podría desplazar suficiente oxígeno como para que constituya un peligro.
- Si se deben usar espacios cerrados, instale monitores de oxígeno. Instruya al personal para que abandone el área de inmediato si suena la alarma. La alarma debe ser audible tanto dentro como fuera de la sala a fin de que nadie entre a la sala.
3.9.3. Peligro de explosión
- Los gases en estado líquido, incluso los que se consideran inertes, pueden representar un peligro de explosión.
- El flujo de calor hacia el líquido criogénico es inevitable a pesar de la calidad del aislamiento. Los líquidos criogénicos tienen pequeñas cantidades de calor latente y se expanden a 700-800 veces su tamaño cuando se calientan a temperatura ambiente. Por lo tanto, incluso una pequeña fuente de calor puede crear grandes aumentos de presión en el recipiente.
- Los recipientes Dewar criogénicos se deben mover con cuidado. El movimiento del líquido hacia regiones más calientes del recipiente puede provocar marcados aumentos de presión.
- No deje caer, incline ni haga rodar los recipientes de costado; esto podría dañar el recipiente y/o causar un marcado aumento de la presión interna.
- Los recipientes criogénicos están equipados con dispositivos de liberación de presión diseñados para controlar la presión interna. Los recipientes criogénicos ventilan gases periódicamente. Eso es normal. No tape, elimine ni modifique ningún dispositivo de liberación de presión.
- Los respiraderos deben protegerse de la formación de hielo y obstrucciones. Cuando todos los respiraderos están cerrados, el gas en expansión puede provocar una explosión. Los respiraderos deben permanecer abiertos en todo momento.
- Use siempre recipientes especiales de temperatura ultrabaja para almacenar nitrógeno líquido. Nunca coloque nitrógeno líquido en termos domésticos porque estos no están diseñados para soportar los cambios grandes y rápidos de temperatura que se producen al colocar nitrógeno líquido en el recipiente (42,43).
- Llene los recipientes Dewar criogénicos con nitrógeno líquido lentamente a fin de minimizar el estrés interno del enfriamiento. Un estrés excesivo puede dañar el recipiente y provocar su falla.
- El helio líquido es lo bastante frío como para solidificar el aire atmosférico. En el volumen de helio de un recipiente Dewar para helio líquido solo debe introducirse o permitir que se introduzca helio. Tome precauciones para impedir la difusión retrógrada del aire al volumen de helio.
- Los puntos de fusión del nitrógeno líquido y el helio líquido están por debajo de los del oxígeno líquido y pueden condensar el oxígeno de la atmósfera. Volver a llenar el sistema repetidas veces puede provocar la acumulación de oxígeno como un contaminante no deseado. Se puede producir un enriquecimiento con oxígeno similar cuando se acumula aire condensado en el exterior de la tubería criogénica. Se podría producir una explosión si se permite que ese líquido rico en oxígeno impregne los materiales aislantes o de otro tipo que no son compatibles con el oxígeno. Además, algunos aceites pueden formar una mezcla explosiva cuando se combinan con oxígeno líquido.
3.9.4. Explosiones de criotubos
- El PPE incluye un protector facial con especificación del ANSI resistente a impactos, guantes gruesos y delantal de laboratorio con botones durante la extracción de criotubos y ampollas de los tanques de nitrógeno.
- Los criotubos y las ampollas de vidrio usados para congelar células y virus pueden explotar sin advertencia cuando se extraen de su almacenamiento criogénico. Se supone que esas explosiones de tubos son causadas por el ingreso de nitrógeno líquido en el tubo a través de grietas diminutas; a medida que el tubo se descongela, el gas, que se expande con rapidez, hace que el tubo explote y disperse su contenido (23).
- Siempre que sea posible, guarde las ampollas en la fase gaseosa, en lugar de sumergirlas en el nitrógeno líquido del recipiente Dewar criogénico. Una ampolla que no está cerrada herméticamente capturará menos nitrógeno en la fase gaseosa.
- El nitrógeno que despide gas de un vial que no está cerrado herméticamente a veces produce un siseo antes de que el vial explote. Si no se oye un siseo no significa que el vial sea seguro. Coloque los criotubos y las ampollas sobre gasa o papel secante en un recipiente de paredes gruesas en un autoclave inmediatamente después de extraerlos del tanque de nitrógeno, y cierre la tapa del recipiente de paredes gruesas rápidamente. Si se produce una explosión, desinfecte todo el recipiente con el autoclave.
3.9.5. Fragilización
- Nunca vierta líquidos criogénicos por el desagüe. La tubería de laboratorio es uno de los muchos materiales comunes que se fragilizan a temperaturas criogénicas y se fracturan con facilidad.
- La madera y otros materiales porosos pueden atrapar el oxígeno a bajas temperaturas y explotarán si se produce un choque mecánico (42).
3.9.6. Peligro de enfermedades infecciosas
- El nitrógeno líquido puede contaminarse cuando las ampollas se rompen en el recipiente Dewar, y los contaminantes se pueden conservar en el nitrógeno (23). Esos contaminantes potencialmente infecciosos pueden contaminar otros viales colocados en el recipiente Dewar y generar un aerosol infeccioso a medida que el nitrógeno líquido se evapora.
- Se recomiendan los criotubos de plástico aptos para temperaturas de nitrógeno líquido para el almacenamiento de nitrógeno líquido, ya que parecen ser más resistentes que las ampollas de vidrio y es menos probable que se rompan en el nitrógeno.
3.10. Peligro de resbalones, tropezones y caídas
Los resbalones, tropezones y caídas pueden hacer que un trabajador del laboratorio deje caer o derrame recipientes que contienen agentes infecciosos o sustancias químicas peligrosas. También pueden llevar a punciones y abrasiones en la piel que vuelven a los trabajadores más vulnerables a las LAI.
Una buena limpieza es la manera más fundamental de reducir los resbalones, tropezones y caídas. Sin una buena limpieza, cualquier otra medida preventiva (p. ej., instalación de pisos sofisticados, calzado especial o capacitación sobre técnicas para caminar y cómo caer de forma segura) nunca será completamente eficaz.
3.10.1. Resbalones
- Las causas frecuentes de resbalones en el laboratorio incluyen superficies húmedas o aceitosas, tapetes o alfombras sueltos que no están sujetos y pisos u otras superficies para caminar que no tienen cierto grado de tracción en todas las áreas.
- La presencia de agua en el piso es el principal peligro de resbalones. Seque cualquier derrame de agua en el piso rápidamente.
- La parafina usada para el montaje y corte de tejidos se puede acumular en las áreas de procesamiento de tejidos y puede dejar el piso resbaladizo a pesar de la limpieza rutinaria, a menos que se tomen medidas especiales para el cuidado de los pisos.
- Los aceites minerales, los líquidos para montaje, los limpiadores de acero inoxidable y otras sustancias químicas y/o reactivos de laboratorio pueden crear peligro de resbalones si caen al piso. Limpie con agua y jabón en cuanto advierta un derrame.
- No use alcoholes para limpiar los pisos; los alcoholes disolverán la cera del piso y crearán áreas con distintos grados de tracción.
- Las alfombras pueden constituir un peligro de resbalones si no están bien sujetas al piso.
- Caminar sobre papeles, cartones u otros materiales de acondicionamiento puede implicar un peligro de resbalones.
3.10.2. Tropezones
- Las causas frecuentes de tropezones incluyen obstrucción de la visión, mala iluminación, objetos en el camino, alfombras u otros objetos en el camino, cables descubiertos, cajones o gabinetes abiertos y superficies desparejas para caminar. No se recomienda el uso de alfombras y tapetes permeables en microbiología, excepto por lo indicado más adelante en la sección.
- Mantenga los cajones y gabinetes cerrados excepto cuando deba acceder a ellos.
- Los objetos desordenados y demás cosas que sobresalen de la parte inferior de mesas o escritorios pueden lesionar a los trabajadores cuando pasan por los pasillos. Mantenga el desorden al mínimo. Asegúrese de que las cajas y demás objetos no sobresalgan hacia los pasillos.
- No tienda cordones ni cables a través de pasillos u otras vías de paso.
- El responsable de seguridad o la gerencia del laboratorio deben evaluar el uso de alfombras ergonómicas antifatiga en otras secciones del laboratorio antes de emplearlas en un área específica del laboratorio. Los puntos de interés que se deben tener en cuenta antes de usar dichas alfombras incluyen los siguientes:
— Estas alfombras son algo gruesas y la superficie elevada representa un peligro de tropiezo.
— Las alfombras son obstrucciones para carros y sillas y pueden hacer que estos se inclinen.
— Dificultan la limpieza de derrames.
— Dificultan la limpieza y desinfección de los pisos al personal de conserjería.
— También pueden poner en riesgo al personal de conserjería si se levantan o se mueven alfombras que se contaminaron accidentalmente con sustancias químicas o agentes infecciosos.
— Los líquidos se suelen absorber bajo la alfombra, ocultando posibles problemas de contaminación.
— Las alfombras presentan un peligro de tropezones/caídas que podría obstaculizar la salida del laboratorio en caso de emergencia.
3.11. Congeladores a temperaturas ultrabajas
Utilice guantes termorresistentes y un delantal de laboratorio al manipular objetos almacenados a temperaturas ultrabajas. Las muestras almacenadas a temperaturas ultrabajas están extremadamente frías [-70 °C a -85 °C]) y, paradójicamente, en contacto directo con la piel provocan quemaduras graves.
3.12. Luz ultravioleta
- La luz UV de onda corta ha tenido varias aplicaciones en el laboratorio, incluido el uso en microscopios de fluorescencia, como desinfectante terminal en algunos sistemas de agua tipo 1 y para visualizar bandas de ácidos nucleicos en geles con tinción de bromuro de etidio.
- La exposición a luz UV de onda corta se ha relacionado con cánceres de piel, fibrosis corneal y quemaduras cutáneas. Esos efectos pueden producirse por la exposición a la luz UV directa o reflejada (44).
- No use luces UV para descontaminar un BSC. Los organismos presentes en grietas, sombras y la parte inferior del equipo no se ven afectados por el tratamiento con luz UV. Además, la radiación y el ozono producidos por esas luces atacarán los objetos de plástico y goma que estén dentro del BSC o en sus alrededores, y eso acorta su vida útil. Esa exposición puede afectar las calibraciones de pipetas mecánicas y otras funciones de equipos sensibles.
- Si se deben usar luces UV por otro motivo en los BSC, proporcione un medio de supervisarlas durante toda su vida útil con sensores de intensidad. Los sensores de UVC calibrados son una manera confiable y rentable de supervisar los niveles de radiación UVC en los BSC. Supervise estas luces, porque las luces UV germicidas tienen una vida útil esperada de 9.000 horas.
- La irradiación UV germicida durante más de 15 minutos es contraproducente porque no agrega un beneficio germicida adicional, pero acelera la degradación de los equipos.
- La lámpara UV nunca debe estar encendida mientras un operador trabaja en el gabinete. No todos los equipos protectores para ojos protegerán a los trabajadores de laboratorio de la exposición nociva a luz UV. Asegúrese de que la protección ocular sea adecuada para protección UVC.
- Use gafas de seguridad UV durante el mantenimiento de rutina de la lámpara o cuando exista el potencial de exposición directa o indirecta (luz reflejada).
- Use guantes, delantal de laboratorio de mangas largas y protector facial completo al trabajar con cajas de visión UV que no tengan filtros protectores.
- En áreas en las que se utiliza luz UV, coloque placas que indiquen “Precaución, luz ultravioleta, use protección ocular”.
3.13. Dispositivos de aspiración al vacío
Los dispositivos de filtración al vacío y los matraces de succión de Kitasato se utilizan en forma rutinaria en el laboratorio general, mientras que en los laboratorios de microscopia electrónica se usan evaporadores al vacío, liofilizadores, criofractura y unidades de recubrimiento con atomización. Los dispositivos de aspiración al vacío presentan peligro de implosión y riesgo de generación de aerosoles.
3.13.1. Seguridad ante implosiones
- Se pueden producir implosiones cuando el diferencial de presión supera las especificaciones del recipiente.
- Las implosiones pueden dispersar restos de vidrio cortantes en todas direcciones y lesionar gravemente a alguien que esté cerca (42,43). También dispersarán cualquier agente infeccioso que esté presente en el recipiente.
- Generalmente, los matraces de succión de Kitasato con paredes gruesas se consideran aptos para soportar el diferencial de presión de una atmósfera (14,7 PSI); los sistemas de vacío domésticos que produzcan diferenciales de presión que superan ese nivel deben regularse con un regulador de presión incorporado.
- Las grietas, desportilladuras y rayones en los recipientes de aspiración al vacío y campanas de cristal pueden debilitar el vidrio y provocar una implosión incluso cuando los reguladores de presión producen los diferenciales apropiados.
- Se debe tener cuidado para prevenir el daño de campanas de cristal y matraces de succión provocado por un uso excesivo o su impacto con objetos duros.
- Se han usado protectores contra implosiones de malla de plástico o cajas de plástico con los matraces de succión a fin de contener los trozos de vidrio si el recipiente se daña. Al manipular agentes infecciosos, sangre o hemoderivados, se recomienda enfáticamente el uso de matraces de plástico.
3.13.2. Generación de aerosoles
- Los purgadores de aspiración al vacío constan de uno o dos matraces de succión conectados en serie con un filtro HEPA integrado (p. ej., dispositivo de purga Vacushield, Pall Life Sciences, Port Washington, NY, o dispositivo equivalente) para prevenir la contaminación de la bomba de vacío o del sistema de vacío doméstico (1).
- Al usar una bomba de vacío exclusiva, muchos laboratorios también incluyen un matraz de succión que contiene Drierite poroso (W.A. Hammond Drierite Co., Ltd, Xenia, OH) o un desecante equivalente para eliminar la humedad del aire y, de esa forma, proteger la bomba. Los purgadores de vacío se usan en virología para eliminar medios de cultivo de los tubos, viales shell y demás recipientes antes de volver a llenarlos u otras manipulaciones celulares. Los sistemas de aspiración también se usan en lavadoras de placas de ensayo de inmunoabsorción enzimática (enzyme-linked immunoassay, ELISA).
- Todos esos dispositivos generan aerosoles al agitar el líquido y colocar la superficie del líquido a presión reducida (23). Los aerosoles pueden depositar agentes infecciosos en las superficies inmediatas y los aerosoles más finos se pueden inhalar.
3.13.3. Medidas de protección contra aerosoles
- Use dispositivos de aspiración en un BSC para contener cualquier aerosol.
- Los operadores deben usar un delantal y guantes de laboratorio desechables para protegerse de las gotas infecciosas.
- Cuando se haya completado la aspiración de un cultivo, deje funcionando el extractor durante 5 minutos para purgar cualquier aerosol transportado por el aire; descontamine las superficies de trabajo de la manera normal.
- Cambie los filtros HEPA incorporados cada 6 meses o cuando estén húmedos o visiblemente bloqueados.
3.13.4. Desecho de residuos líquidos de purgadores de vacío
- Nunca vierta residuos infecciosos en el desagüe.
- Descontamine los residuos líquidos de los purgadores de vacío con lejía antes de desecharlos.
- Al usar un purgador de vacío conectado a una bomba de vacío individual, los laboratorios suelen pasar los vapores por un purgador de carbón activado para proteger la bomba de la corrosión por el vapor de cloro.
- Existen diversas configuraciones de los purgadores de succión posibles, y la configuración final dependerá del flujo de trabajo y la práctica individual de cada laboratorio. Los siguientes procedimientos son aplicables a todas las configuraciones.
— Cambie los matraces de aspiración de vacío cuando estén tres cuartos llenos a fin de prevenir el llenado excesivo. Algunos laboratorios prefieren alcanzar la marca de máximo volumen del matraz y agregar un volumen suficiente de lejía al inicio del día para producir una solución de lejía 1:10 cuando los líquidos aspirados llegan a la marca de volumen máximo.
— Desinfecte la manguera aspirando el purgador con entre 10 y 50 ml de solución de lejía recién preparada. Levante la manguera para que la lejía ingrese al purgador. Espere 20 minutos, luego retire el purgador del BSC.
— Una vez descontaminado, el líquido no se considera infeccioso y puede verterse en el desagüe sanitario.
Nota para el laboratorio de virología: La lejía reducirá el tinte del rojo fenol en los medios de cultivo celular y la solución pasará de roja a incolora. Si no se produce ese cambio de color, el líquido no se descontaminó y debe agregarse lejía suficiente para descontaminar el recipiente.
3.14. Peligros biológicos
3.14.1. Punciones y cortes
Las punciones y cortes en la piel pueden introducir en forma directa un agente infeccioso en el cuerpo y pueden constituir una vía por la que puede ingresar un segundo agente.
- Punciones con aguja (45):
— Los laboratorios clínicos deben establecer un programa de prevención de punciones con agujas y lesiones con objetos cortopunzantes.
— Limite el uso de agujas y jeringas a los procedimientos para los que no existen métodos alternativos. Las lesiones de punción por aguja suelen producirse al volver a colocar las vainas protectoras de las agujas después de usarlas.
— No vuelva a envainar las agujas. Si es absolutamente necesario que vuelva a envainar una aguja, se debe utilizar un dispositivo para volver a envainar agujas a fin de minimizar las lesiones e inoculaciones accidentales.
— No utilice dispositivos para cortar agujas, ya que estos pueden producir aerosoles infecciosos. Después del uso, coloque las agujas y jeringas en recipientes a prueba de fugas y punciones con el rótulo adecuado de las palabras “Peligro biológico” y el símbolo universal de peligro biológico para su descontaminación y desecho.
— No doble, corte, vuelva a tapar ni retire agujas de las jeringas desechables ni las manipule de otro modo con las manos antes de desecharlas.
— Las cuchillas del micrótomo/criostato utilizadas para cortar secciones congeladas son otro posible objeto cortopunzante que debe manejarse con cuidado. Use guantes resistentes a cortes al desensamblar la cuchilla potencialmente contaminada para su limpieza y desinfección. - Roturas
— Nunca levante vidrios rotos con guantes o sin ellos. Use fórceps, cucharas de plástico desechables, pinzas o hemostatos para levantar vidrios rotos; deseche el vidrio roto en un recipiente para objetos cortopunzantes. Coloque una escoba o cepillo de mano y una pala en diversos laboratorios o en el armario de limpieza para levantar vidrios no contaminados.
— No use los objetos de vidrio rotos o astillados. Deséchelos en el recipiente para objetos cortopunzantes correspondiente con el rótulo para vidrios rotos.
— Al manipular recipientes rotos con sustancias infecciosas derramadas, respete las siguientes pautas (1).-
Use los guantes apropiados para ese procedimiento (según la evaluación de riesgo y la protección necesaria).
-
Cubra el recipiente roto y la sustancia infecciosa derramada con un paño o toallas de papel.
-
En un laboratorio BSL-2 de rutina, vierta un desinfectante o solución de lejía común 1:10 recién preparada sobre el área cubierta y deje actuar durante 20 minutos, como mínimo. Después de un derrame, se tardarían 23 minutos en despejar el aire de M. tuberculosis transportada por aire con una eficacia de eliminación del 99 % si la sala tuviera 12 renovaciones de aire por hora, y 35 minutos para esa eliminación con una eficacia del 99,9 % (46). Dada la variabilidad de la cantidad de renovaciones de aire de la sala por hora en los laboratorios de diagnóstico, el tiempo de espera debe evaluarse detenidamente.
-
El paño o las toallas de papel y el material roto deben desecharse en los receptáculos para objetos cortopunzantes con peligro biológico. Los fragmentos de vidrio deben manejarse con fórceps, no con guantes en las manos. (Hacer un bollo de cinta adhesiva y usarlo con fórceps facilita ese procedimiento). También existen pequeñas aspiradoras HEPA para la eliminación de partículas finas de vidrio.
-
- Si se contaminan formularios u otros materiales impresos o escritos del laboratorio, la información de los formularios o materiales escritos debe copiarse en otro formulario y desechar el original en el recipiente para residuos con peligro biológico.
- Pipetas Pasteur
— Siempre que sea posible, reemplace por plástico o evalúe el procedimiento para determinar si ahora existe una técnica más nueva o mejor.
— Tanto la parte inferior como la superior de una pipeta Pasteur pueden provocar heridas por punción.
— Antes de manipular una pipeta Pasteur de vidrio, examine la parte superior de la pipeta para ver si está rota o agrietada. Las pipetas rotas pueden producir heridas por punción.
— Al colocar pipetas Pasteur de vidrio en líneas de succión, sostenga la pipeta por la parte superior y no permita que la mano se extienda más allá del extremo. Una técnica apropiada al apoyar la pipeta puede producir heridas por punción si la mano resbala o la pipeta se rompe.
— Deseche las pipetas Pasteur usadas en recipientes resistentes a fugas y punciones. En la mayoría de los lugares, las pipetas Pasteur contaminadas se consideran objetos cortopunzantes y se deben desechar como tales. - Otros objetos cortopunzantes
— Las cuchillas, tijeras y homogenizadores de tejido se usan con frecuencia para disociar muestras de tejido antes de su análisis. Esos objetos deben manipularse con cuidado a fin de prevenir cortes y punciones en la piel que puedan lesionar o inocular a los empleados del laboratorio materiales infecciosos.
— Los fórceps puntiagudos suelen usarse para la disociación fina y para retirar cubreobjetos de los viales shell. Esos fórceps pueden pinchar al usuario imprudente y provocarle una lesión y/o infección.
— Los portaobjetos de vidrio pueden romperse y pinchar la piel.
— Los tubos para cultivo y los viales shell pueden agrietarse o hacerse añicos si se fuerzan los tapones. Los fragmentos resultantes pueden penetrar fácilmente los guantes de látex y la piel.
— Los bordes de los recipientes de vidrio pueden estar astillados y esas superficies astilladas pueden cortar a los empleados de laboratorio imprudentes. Deseche los objetos de vidrio astillados lo antes posible. - Desecho de objetos cortopunzantes
— Coloque cuidadosamente las agujas desechables, jeringas, escalpelos, cuchillas, pipetas y objetos similares en recipientes adecuadamente rotulados resistentes a fugas y punciones creados para desechos. La mayoría de las autoridades exigen que las agujas y jeringas se desechen en recipientes para objetos cortopunzantes de ese tipo, ya sea que estén usadas o no.
— Coloque los recipientes para desechar objetos cortopunzantes en el lugar en el que se los usa o cerca de allí a fin de prevenir la contaminación ambiental y lesiones relacionadas con la acumulación de objetos cortopunzantes en el lugar de su generación y de su traslado de un lugar a otro.
— Reemplace los recipientes para objetos cortopunzantes que están dos tercios llenos o tres cuartos llenos. Los recipientes para objetos cortopunzantes deben tener un cierre seguro para transportarlos a las áreas de descontaminación. Pueden producirse lesiones cuando el personal del laboratorio trate de cerrar los recipientes llenos a la fuerza. Los recipientes que están demasiado llenos pueden volver a abrirse y entrañar un peligro para los demás trabajadores.
— Coloque los objetos cortopunzantes que no son desechables en un recipiente de paredes rígidas, con tapa, resistente a fugas, para su traslado a un área de procesamiento para descontaminación, de preferencia, mediante autoclave (1).
— Coloque los materiales que se descontaminarán fuera del centro en un recipiente para traslado de residuos médicos y ciérrelo para su transporte de acuerdo con las reglamentaciones estatales, locales y federales que correspondan (1).
— Coloque los objetos cortopunzantes limpios y sin contaminar (p. ej., objetos de vidrio limpios rotos, pipetas limpias astilladas) en recipientes rígidos resistentes a punciones para desecharlos mediante el proceso normal de desecho de basura. Cierre los recipientes con cinta adhesiva para prevenir su apertura accidental y posibles lesiones.
— Nunca coloque objetos cortopunzantes directamente con la basura común. Podrían lesionar al personal de conserjería o a otros integrantes del personal al retirar las bolsas de basura de los recipientes para basura rígidos.
3.14.2. Ingestión y contacto con agentes infecciosos
- No se toque los ojos, nariz, boca y labios mientras esté en el laboratorio.
- No se lleve plumas, lápices, gafas de seguridad u otros objetos del laboratorio a la boca, ni los coloque junto a los labios.
- No guarde alimentos ni bebidas para consumo humano en el laboratorio.
- Está prohibido llevarse las pipetas a la boca; se deben usar dispositivos mecánicos para transferencia con pipetas.
- No está permitido comer, beber, fumar, tocar lentes de contacto ni aplicarse cosméticos en el laboratorio.
- Lávese las manos después de trabajar con materiales posiblemente peligrosos y antes de irse del laboratorio. El laboratorio debe tener un lavabo para lavarse las manos, preferiblemente, ubicado cerca de la salida del laboratorio.
- Deben usarse guantes para proteger las manos de la exposición a materiales peligrosos. En el área de biología molecular, los guantes también protegen a las muestras de las nucleasas que están en la piel.
— Cámbiese los guantes cuando estén contaminados, se haya comprometido su integridad o en cualquier otro momento que sea necesario.
— Sáquese los guantes y lávese las manos cuando haya terminado el trabajo con materiales peligrosos y antes de salir del laboratorio.
— No lave ni vuelva a usar los guantes desechables.
— Nunca se toque la cara, la boca, los ojos u otras membranas mucosas cuando esté usando guantes en el laboratorio.
— Dado que los guantes que se usan en el laboratorio de diagnóstico se consideran potencialmente contaminados, colóquelos en los recipientes para residuos con peligro biológico al desecharlos.
— Sáquese los guantes al contestar el teléfono o usar equipos compartidos, como las computadoras. - Para prevenir la contaminación de las manos sin guantes, diseñe el laboratorio de modo que estas puedan lavarse fácilmente.
— Descontamine las superficies de trabajo con un desinfectante apropiado al terminar de trabajar y después de cualquier derrame o salpicadura de material potencialmente infeccioso (consulte la Sección 3.4, Desinfección).
— Las superficies de las mesas deben ser impermeables al agua y resistentes al calor, solventes orgánicos, ácidos, álcalis y otras sustancias químicas.
— Las sillas usadas para el trabajo de laboratorio deben cubrirse con un material no poroso que se limpie fácilmente. Las sillas tapizadas en tela sin fundas no son apropiadas. - Los teléfonos son vehículos potenciales para la transferencia de agentes infecciosos a la cara y las membranas mucosas, y deben emplearse teniendo eso en cuenta.
— Nunca levante el auricular ni marque los números de un teléfono con los guantes colocados.
— Desinfecte los teléfonos regularmente con desinfectantes. (Los alcoholes no inactivan los virus sin envoltura ni destruyen el ADN.)
— Use las características de teléfono manos libres o altavoz cuando sea posible para evitar el contacto entre el auricular y la cara. - Nunca lleve maletines, bolsos, mochilas, libros, revistas y demás objetos personales al laboratorio. Esos objetos son difíciles de desinfectar.
3.14.3. Derrames y salpicaduras en la piel y las membranas mucosas
- Es responsabilidad de todos los empleados de laboratorio realizar todos los procedimientos de forma tal que se minimice la generación de salpicaduras y aerosoles.
- Todas las salpicaduras a los ojos deben enjuagarse durante por lo menos 15 minutos. Si un empleado de laboratorio que usa lentes de contacto recibe una salpicadura en un ojo, debe enjuagarlo con agua, retirar la lente y volver a enjuagar el ojo. Deseche las lentes de contacto desechables. Desinfecte las lentes de contacto reutilizables antes de volver a colocárselas. Tal vez sea necesario consultar al fabricante.
- Los recipientes para muestras, tubos para cultivo, viales shell y demás recipientes cilíndricos usados en el laboratorio se inclinan fácilmente hacia los lados y podrían rodar al colocarlos sobre la mesa de trabajo. Los recipientes de vidrio pueden romperse si se los deja caer. Coloque los recipientes en soportes siempre que sea posible para prevenir las oportunidades de roturas.
3.14.4. Aerosoles y gotas
Cualquier procedimiento que imparta energía a una suspensión microbiológica puede producir aerosoles infecciosos (1,23). Los procedimientos y equipos asociados frecuentemente con la producción de aerosoles incluyen la transferencia con pipetas, mezclar con pipeta en un mezclador de vórtice y el uso de mezcladores, centrifugación y dispositivos de ultrasonido (sonicadores) (1,23,47). Esos procedimientos y equipos generan partículas respirables que siguen siendo transportables por aire durante períodos prolongados. Al inhalarlas, esas partículas diminutas pueden alojarse en los pulmones.
Esos procedimientos y equipos también generan gotas más grandes que pueden contener mayores cantidades de agentes infecciosos. Las gotas más grandes se disocian del aire rápidamente, contaminando superficies de trabajo además de las manos con guantes y, posiblemente, las membranas mucosas de las personas que están realizando el procedimiento.
Las partículas respirables son relativamente pequeñas y no varían en gran medida en cuanto al tamaño y la distribución. En contraste, la contaminación de las manos y las superficies es marcada y varía mucho (1,48). El riesgo potencial de la exposición a gotas de mayor tamaño requiere tanta atención en una evaluación del riesgo como el riesgo de las partículas respirables.
- Transferencia con pipetas
Las pipetas y los procesos de transferencia con pipetas pueden ser fuentes apreciables de aerosoles infecciosos y contaminación ambiental. Por lo tanto, es prudente usar guantes, protección ocular y un delantal de laboratorio con puños tejidos al hacer transferencias con pipetas y realizar dichas operaciones en un BSC. Las siguientes pautas se categorizan en pautas para pipetas serológicas y pipetas mecánicas.
— Pipetas serológicas. Cuando se extrae la última gota de líquido a la fuerza del extremo de la pipeta, se forman gotas de aerosoles pequeñas y grandes que contaminan las manos y el ambiente (23). Para minimizar la generación de aerosoles, coloque el extremo de la pipeta contra la pared interior de los tubos, matraces u otros recipientes y extraiga suavemente las últimas gotas de líquido.
— Al dispersar cúmulos celulares, los virólogos suelen extraer e introducir líquidos en la pipeta para homogeneizar las muestras y las suspensiones celulares. Durante ese proceso, se produce una cantidad sustancial de aerosolización, en especial cuando el líquido se extrae a la fuerza del extremo de la pipeta. De manera similar, se generan aerosoles durante la “mezcla con pipetas” de las diluciones de cultivos. La mezcla en vórtice de tapa cerrada es el método preferido para este tipo de mezcla. Si se necesita mezclar con pipetas, mantenga el extremo de la pipeta por debajo de la superficie del líquido y no haga salir todo el volumen de líquido de la pipeta. Eso reducirá la aerosolización y la formación de burbujas.
— El uso vigoroso de la pipeta (aspiración rápida de líquido en la pipeta) puede generar aerosoles dentro de las pipetas. Algunos aerosoles quedarán atrapados por el tapón de algodón del extremo proximal de la pipeta. Sin embargo, algunos aerosoles pueden atravesar el tapón de algodón y contaminar el dispositivo de la pipeta. Ciertos dispositivos de pipetas mecánicas tienen filtros HEPA que minimizan la contaminación del dispositivo manual. Cambie esos filtros regularmente y siempre que se mojen. Descontamine los bulbos de las pipetas regularmente y siempre que se contaminen.
— Pipetas mecánicas. Los dispositivos manuales de pipetas mecánicas se usan para análisis mediante inmunoensayo enzimático (enzyme immunoassay, EIA), diagnóstico molecular y otras actividades que requieren precisión.
— En el diagnóstico molecular, la contaminación de la pipeta es la causa más frecuente de resultados falsos positivos (49). La contaminación de la pipeta puede producirse por aerosoles, por tocar el exterior de la pipeta con una superficie contaminada y por contaminar el interior de la pipeta durante el proceso de transferencia.
— Extraer el último líquido restante del extremo producirá salpicadura de gotas y formación de aerosoles. Esos aerosoles y gotas pueden contaminar las demás muestras y el ambiente. La mayoría de los dispositivos de pipetas mecánicas tienen dos interruptores en el émbolo: el interruptor “Administrar” y el interruptor “Extraer”. La exactitud de los volúmenes de las pipetas se calibra en el interruptor “Administrar”, y por lo tanto, no es necesario extraer la cantidad final de líquido para conservar la exactitud de la transferencia con la pipeta.
— Apoye los extremos de las pipetas en el interior del pocillo o el tubo antes de presionar el émbolo de administración. Nunca dirija el flujo del contenido de la pipeta hacia el centro del pocillo porque eso producirá salpicaduras y contaminación.
— Debe tenerse cuidado al eyectar extremos usados en los recipientes de residuos ya que el líquido restante puede esparcirse y salpicar a gran distancia.
— El exterior del barril de la pipeta puede contaminarse por salpicaduras, aerosoles o por tocar el barril con objetos contaminados. No extienda el barril de la pipeta en un reactivo, muestra o recipiente para residuos. Si los extremos de longitud normal no llegan al líquido del tubo, use extremos de pipetas de mayor alcance para prevenir la contaminación del barril.
— Desinfecte las pipetas mecánicas regularmente según las instrucciones del fabricante o con una dilución 1:10 de lejía común seguida de alcohol al 70 % para eliminar la mayor cantidad posible de lejía.
— El uso de extremos de pipetas resistentes a aerosoles puede reducir sustancialmente la contaminación por ácidos nucleicos en el interior de la pipeta. Los extremos resistentes a aerosoles contienen un filtro hidrofóbico microporoso que está unido a las paredes del extremo de la pipeta. El filtro microporoso atrapa los aerosoles antes de que estos contaminen el barril de la pipeta. Esos filtros también pueden prevenir la contaminación de la muestra cuando se utiliza accidentalmente una pipeta contaminada (49).
— Cuando una gota cae accidentalmente del extremo de una pipeta contra una superficie dura, genera aerosoles y una serie de pequeñas gotas, algunas de las cuales pueden ser lo bastante grandes para caer y repetir el proceso (50). Se produce una mayor contaminación cuando las gotas caen sobre una superficie dura desde una mayor distancia.
— Muchos laboratorios usan papel comercial para mesas recubierto con plástico en los BSC y las mesas de trabajo del laboratorio para contener o absorber la contaminación de las gotas que caen.
— Ante la inevitabilidad de una gota que cae, es mejor bajar el extremo de la pipeta y permitir que la gota caiga a una distancia corta sobre una toalla absorbente. Ese procedimiento minimizará la energía cinética de la gota y su capacidad de salpicadura. - Tubos y otros recipientes
— En ocasiones se forma una delgada película en el cuello de los tubos para cultivo, viales shell, tubos de microcentrífugas, viales para muestras y otros recipientes. Romper o reventar esta película produce aerosoles y salpicaduras de microgotas que contienen agentes infecciosos, ácidos nucleicos u otros posibles contaminantes (23).
— Los recipientes que tengan una delgada película en el cuello deben volver a taparse y centrifugarse siempre que sea posible, a fin de quebrar la película o hacer que se fusione con el líquido del recipiente.
— Si la centrifugación no es posible (p. ej., con matraces para cultivo), coloque una gasa u otro material absorbente sobre la abertura e inserte una pipeta en el matraz para quebrar la película. Deseche la pipeta y el material absorbente con el resto de los materiales contaminados.
— Los tubos para microcentrífuga y otros tubos cerrados con tapón a menudo producen aerosoles y salpicaduras al abrirlos. Los tubos para microcentrífuga con tapa a rosca pueden reducir ese riesgo.
— Para minimizar la cantidad de líquido de la tapa, someta los tubos para microcentrífuga a un “pulso” de centrifugación rápido antes de abrirlos.
— Abra los tubos para microcentrífuga en un BSC siempre que sea posible.
— Al abrir los tubos para microcentrífuga cerrados con tapón, tape la parte superior del tubo con material absorbente (p. ej., gasa embebida en alcohol) para detener cualquier salpicadura que pudiera ocurrir. Deseche el material absorbente con el resto de los materiales contaminados. - Materiales liofilizados, viales para suero y ampollas
Abrir viales de material secado por congelación (liofilizado) puede ser peligroso porque esos polvos secos y finos se dispersan fácilmente en la atmósfera cuando ingresa aire en el recipiente evacuado (23). Pueden usarse los siguientes procedimientos para abrir en forma segura un vial de suero con material liofilizado.
— Lleve el vial y el diluyente sugerido (agua o medio, según corresponda) a un BSC.
— Use guantes y un delantal de laboratorio al abrir viales liofilizados.
— Use un hemostato para retirar la tapa de aluminio del vial. Deseche el material de la tapa en el recipiente para objetos cortopunzantes.
— Cubra el tapón con un paño de gasa húmedo y, con cuidado, levante el borde del tapón y deje entrar aire lentamente en el vial. No altere el contenido del vial.
— Una vez que se haya liberado el vacío, retire el tapón por completo y colóquelo boca abajo sobre papel absorbente.
— Agregue la cantidad apropiada de diluyente en el vial con una pipeta estéril.
— Vuelva a tapar y deje que el contenido del vial se hidrate durante varios minutos.
— Deseche la gasa, el tapón y el papel absorbente con el resto de los materiales contaminados.
— Con una pipeta, transfiera el contenido del vial a un recipiente adecuado.
— Deseche el vial original con el resto de los materiales contaminados.
— No se recomiendan los métodos con aguja y jeringa para remover agentes infecciosos de los viales para suero porque estos pueden contaminar el ambiente y se prestan a que se produzcan lesiones por punción con aguja. Use fórceps, no agujas, para retirar los tubos con separador de suero atascados en los soportes de la centrífuga. - Ampollas de vidrio
— Una vez abiertas, las ampollas de vidrio pueden implicar un riesgo de cortes y punciones.
— Los abridores de seguridad de ampollas pueden prevenir lesiones al cubrir la ampolla durante el proceso de apertura.
— En el caso de ampollas que contienen materiales infecciosos, cubra la línea de marca con gasa humedecida con desinfectante; luego, abra la ampolla como de costumbre con el abridor de seguridad de ampollas.
— Coloque el abridor de ampollas en un vaso de precipitados con una solución 1:10 de lejía después de abrir una ampolla.
3.15. Dispositivos de ultrasonido
- Los dispositivos de ultrasonido se utilizan principalmente para lisar bacterias y virus y para limpiar objetos de vidrio y equipo de laboratorio.
- Use la configuración de la mínima potencia eficaz para minimizar la generación de aerosoles.
- Tape los baños de ultrasonido mientras el dispositivo está en uso.
- Los artículos destinados a la limpieza con ultrasonido deben ser descontaminados apropiadamente antes de la limpieza para prevenir la aerosolización de agentes infecciosos (23).
- Realice siempre los procedimientos de lisis y homogeneización de organismos en recipientes cerrados.
- Cambie los líquidos del baño con frecuencia para prevenir la aerosolización de contaminantes bacterianos y micóticos presentes en el baño.
3.16. Áreas limpias en comparación con áreas sucias del laboratorio
En el laboratorio de microbiología, todas las áreas de trabajo técnico del departamento se consideran áreas sucias. Los mismos conceptos de demarcación y separación de las áreas de análisis molecular que se describen en esta sección pueden usarse para establecer áreas limpias y sucias en otras partes del laboratorio de diagnóstico.
3.16.1. Áreas limpias
- Use delantales de laboratorio de distinto color en las áreas limpias y sucias del laboratorio (ubíquelas en la entrada a las áreas limpias) o disponga que no se usen delantales de laboratorio en las áreas limpias.
- Descontamine los materiales y dispositivos reutilizables (p. ej., teléfono, relojes, computadoras, cajas de pañuelos, libros de trabajo) que se lleven al área limpia, a menos que se sepa que son nuevos, y aplique inmediatamente una cinta de codificación por colores designada para el laboratorio.
- Un recordatorio visual en los objetos pequeños, como libros de trabajo, cajas de pañuelos y lapiceras, puede identificar fácilmente los objetos ubicados en un área limpia.
- Demarque la separación en el piso de las áreas sucias y limpias con cinta adhesiva (la cinta debe ser resistente a la limpieza de los pisos) para denotar claramente los límites de las áreas limpias y sucias.
- Elabore una política para la limpieza y mantenimiento de las áreas limpias.
- Capacite a todo el personal (incluido el personal de mantenimiento) sobre cómo identificar y mantener las áreas limpias y cómo reconocer la significación de la cinta de demarcación y otros medios para la identificación de las áreas.
- Documente la capacitación y evalúe la competencia en el uso y el mantenimiento de las áreas limpias.
3.16.2. Oficinas
Las oficinas (p. ej., de supervisores y del director del laboratorio) que dan al laboratorio clínico representan áreas híbridas dentro del laboratorio. Esas oficinas por lo general no están diseñadas ni mantenidas de manera tal que permitan una desinfección sencilla o eficiente.
- Cuente con un suministro de desinfectante en gel para manos en todas las oficinas y áreas de trabajo y use el gel con frecuencia.
- Los componentes de las oficinas que deberían permanecer limpios pero que pueden pasarse por alto incluyen:
— documentos, informes y registros del laboratorio; equipo pequeño; lapiceras; manuales de procedimientos y otros objetos que estuvieron en el laboratorio y que podrían haber sido manipulados con guantes;
— alfombras y sillas que son difíciles de desinfectar;
— libros, revistas y otros materiales de referencia que pueden llevarse al laboratorio o usarse fuera del laboratorio;
— objetos personales (p. ej., fotografías, premios, maletines, chaquetas, botas, mochilas, bolsos, dispositivos electrónicos personales) que son difíciles de desinfectar y que no estarían permitidos en el laboratorio general y
— productos comestibles. - Designar las áreas de oficina como “limpias” no necesariamente las vuelve no contaminadas o las mantiene de ese modo, en especial cuando se llevan objetos posiblemente contaminados a la oficina y los materiales de referencia y documentos pasan sin restricciones entre la oficina y el laboratorio. Los siguientes procedimientos pueden ayudar a reducir el riesgo de contaminación en las áreas de oficina del laboratorio.
— Nunca lleve muestras, cultivos, muestras para aptitud ni objetos similares a las áreas de oficina.
— Sáquese el PPE y lávese las manos antes de ingresar a las oficinas.
— Establezca un área limpia exclusiva y protegida para los objetos personales (p. ej., bolsos, maletines y objetos similares).
— Desinfecte los escritorios y espacios de trabajo personales, teléfonos y teclados de computadora de las áreas de oficina regularmente.
— No se toque los ojos, nariz, boca y labios mientras esté en las áreas de oficina.
No se lleve lapiceras, lápices, patillas de las gafas u otros objetos a la boca ni los coloque sobre los labios.
— No se aplique cosméticos ni permita su uso en las áreas de oficina.
— No guarde comida en la oficina.
— Lávese las manos después de trabajar en la oficina y antes de ingresar a las áreas comunes, como áreas de descanso, áreas administrativas, cafetería y biblioteca.
— Evite mantener objetos desordenados en las áreas de oficina en la mayor medida posible. Las cajas, papeles y demás objetos dificultan la limpieza y descontaminación de la oficina.
— Los directores y supervisores de laboratorio son responsables de evaluar los riesgos de exposición asociados con el uso de documentos y materiales de referencia del laboratorio en las áreas sucias del laboratorio y de elaborar políticas de uso para minimizar esos riesgos.
3.16.3. Áreas sucias
- Todas las áreas del laboratorio de trabajo (incluidos todo el equipo, los teclados, los residuos y las superficies) se consideran áreas “sucias”.
- Actualmente no hay estándares disponibles que describan los procedimientos operativos dentro de las áreas sucias del laboratorio. El personal de laboratorio debe estar atento para reconocer el potencial o riesgo de transmisión de un agente etiológico al tocar objetos de esas áreas.
3.17. Instrumentación
Ya sea que sean automáticos o manuales, los procedimientos que tienen el potencial de producir aerosoles y gotas de muestras (p. ej., al retirar tapones, procesar en vórtice, abrir o perforar tubos evacuados, usar dispensadores automáticos de muestras) requieren el uso de PPE y controles de ingeniería diseñados para prevenir la exposición a agentes infecciosos.
3.17.1. Baños de agua y cubas de agua (humidificación) en incubadoras de CO
- Límpielos regularmente aunque se agreguen desinfectantes al agua.
- Para reducir la biocarga, agregue desinfectantes como un detergente fenólico, fungicidas o alguicidas al agua según sea necesario. Evite el uso de azida sódica para prevenir el crecimiento de microorganismos, ya que esta forma compuestos explosivos con ciertos metales.
- Eleve la temperatura a 90 °C o más durante 30 minutos una vez a la semana a los fines de descontaminación.
- Limpie inmediatamente después de un derrame o rotura.
- Los baños de agua y las cubetas de humidificación de las incubadoras de CO pueden albergar bacterias, algas y hongos que se aerosolizan cuando se abre la tapa del baño de agua o las puertas de la incubadora. Esos aerosoles pueden contaminar los cultivos y el ambiente.
- Vacíe y limpie los baños de agua y las cubetas de humidificación regularmente para minimizar la acumulación de organismos y la producción de biopelículas que son notablemente difíciles de eliminar.
3.17.2. Centrífugas y citocentrífugas
- Las centrífugas pueden ser instrumentos extremadamente peligrosos si su limpieza, mantenimiento y funcionamiento no son apropiados. Se debe capacitar al personal del laboratorio sobre el funcionamiento de la centrífuga y los peligros asociados con la centrifugación.
- Las reglamentaciones actuales que rigen la fabricación de centrífugas garantizan que los operadores estén protegidos contra lesiones y exposiciones posibles mediante el accesorio de trabas para tapas que impiden la apertura de la tapa mientras el rotor sigue girando, detectores de desequilibrio y dispositivos para prevenir la velocidad excesiva del rotor, y que los materiales de construcción puedan tolerar cualquier fallo del rotor. Las centrífugas más viejas que no cuentan con esas medidas de prevención deben operarse con extremada precaución, y los laboratorios deben tener evaluaciones de riesgo documentadas y manuales de operación que brinden específicamente instrucciones de operación para mitigar esos peligros específicos.
- Cada tipo de centrífuga determinado debe tener un manual operativo.
- Los operadores deben tener capacitación documentada y evaluaciones de competencia sobre cada tipo de centrífuga que operen. La instrucción documentada para cada tipo de centrífuga incluye cómo encender y apagar correctamente el instrumento, procedimientos de emergencia y desactivación, cómo equilibrar los tubos, uso de pocillos y tapas de seguridad, selección de rotor y recipientes, requisitos para centrífugas de alta velocidad y ultracentrífugas y limitaciones de la altura de llenado de los recipientes.
- Opere todas las centrífugas de alta velocidad y ultracentrífugas en una superficie estable libre de resonancia (piso, mesa de trabajo o mesa resistente) con un espacio de al menos 6 pulgadas a los lados y 4 pulgadas en la parte posterior de la centrífuga.
- En áreas BSL-2 o superior, los rotores necesitan contención de aerosoles (anillos “O”) y pocillos de seguridad con juntas.
- Cargue y descargue los rotores en un BSC, en especial en las secciones de virología y micobacteriología.
- Deben hacerse cumplir estrictamente las instrucciones del fabricante para el uso y el cuidado de las centrífugas, en especial los rotores, a fin de prevenir los graves peligros y exposiciones potenciales asociados con una falla de los rotores. Guarde los rotores en un espacio limpio exclusivo para este fin y en un ambiente especificado por el fabricante.
- Limpie las centrífugas al final de cada turno e inmediatamente después de un derrame.
- Nunca opere las centrífugas si hay derrames visibles de sangre o fluidos corporales.
- Los rotores requieren pruebas anuales de estrés y un análisis certificado completo; la mayoría de los fabricantes de centrífugas ofrecen ese servicio.
- Mantenga un registro completo y exhaustivo de los rotores de todas las centrífugas de alta velocidad y ultracentrífugas que incluya todos los nombres de los usuarios, fechas de uso, duraciones, velocidades, revoluciones totales de los rotores y cualquier comentario sobre el estado de los rotores.
- Retire los rotores después de haber alcanzado las revoluciones o años de uso recomendados por el fabricante, lo que suceda primero, a menos que una prueba anual de estrés (de Magnaflux [Glenview, IL] u otro análisis reconocido a nivel profesional) demuestre que no hay fallas estructurales. La planificación presupuestaria a largo plazo para este evento es importante.
- Durante el funcionamiento normal, el aire emitido por los puertos de ventilación de la centrifugación a altas velocidades y cualquier partícula infecciosa presente en el flujo de aire se dispersarán rápida y ampliamente (47).
- La rotura de los tubos durante la centrifugación presenta el mayor riesgo de contaminación porque se producen grandes nubes de aerosoles. Puede haber contaminación oculta al centrifugar tubos que no tienen tapas de seguridad con juntas.
- El flujo de aire que rodea los tubos puede crear un efecto Venturi que puede extraer líquido de las roscas de los tubos con tapa a rosca. El flujo de aire a alta velocidad también puede aerosolizar materiales secos o líquidos que podrían estar presentes en la parte exterior del tubo.
- El uso sistemático de pocillos de seguridad con junta para centrífuga y de rotores sellados puede reducir sustancialmente los riesgos asociados con la centrifugación de materiales infecciosos o que podrían serlo.
- El equipo de centrifugación debe tener un mantenimiento apropiado para prevenir fallas de funcionamiento y formación de aerosoles dentro de la centrífuga.
- Proporcione un kit para derrames de la centrífuga que contenga un desinfectante compatible con los materiales de la centrífuga, guantes resistentes a punciones, pinzas o fórceps, algodón, hemostatos, escoba, cepilla de mano y pala.
- Si se rompe un tubo con una muestra dentro del bote o cubeta de plástico con tapa a rosca de una centrífuga, siga los siguientes pasos:
— Apague el motor y espere a que los aerosoles se asienten antes de abrir la centrífuga.
— Retire el bote y colóquelo en un BSC.
— Notifique a un supervisor o persona de más rango a cargo y a otros colegas que trabajen en el área.
— Con la ropa protectora colocada, abra el bote en el BSC.
— Vierta una dilución 1:10 de lejía o un desinfectante no corrosivo en el bote para descontaminar todas las superficies; deje el bote sumergido en la solución de lejía o desinfectante durante 20 minutos. Cierre el bote herméticamente.
— No levante vidrios rotos con las manos con guantes. Use fórceps o algodón sostenido con un fórceps, o pinzas o hemostatos y deséchelos en un recipiente de bioseguridad para objetos cortopunzantes
— Deseche todos los materiales no cortopunzantes contaminados del bote en una bolsa roja para residuos de peligro biológico a fin de desecharlos con los residuos de peligro biológico.
— Limpie o pase un paño con el mismo desinfectante por los tubos tapados intactos; luego repita este procedimiento, lave con agua y seque.
— Todos los materiales usados durante la limpieza deben tratarse como residuos infecciosos.
Nota: Si los tubos para muestras se rompen en una centrífuga que no tiene botes individuales pero tiene una tapa de protección contra peligros biológicos y un rotor sellado, siga las instrucciones del fabricante para la limpieza y la descontaminación.
3.17.3. Analizadores automáticos
- Los analizadores automáticos suelen tener características agregadas que ayudar a reducir las exposiciones de los operadores, pero no eliminan totalmente el potencial de exposición. Una característica común de los sistemas más nuevos es un sistema cerrado de obtención de muestras.
- Las sondas de muestras que se mueven o administran líquidos rápidamente podrían generar aerosoles y gotas.
- Use siempre los instrumentos siguiendo las instrucciones del fabricante.
- Asegúrese de que los protectores de seguridad de los instrumentos y dispositivos de contención estén en su lugar en el momento de usarlos.
- Limite la cantidad de movimientos de las manos cerca de la sonda de muestras y los sensores de nivel de líquido.
- Use guantes y paños de gasa con recubrimiento de plástico impermeable del lado de los instrumentos del que el operador debe limpiar las sondas de muestras después de la obtención de las muestras.
- Los instrumentos más nuevos tienen ciclos de limpieza automática de las sondas, lo cual elimina esta fuente de exposición.
- Manipule las bandejas de muestras y placas de muestras con precaución y cúbralas cuando no se estén obteniendo muestras a fin de evitar derrames.
- Llene los pocillos para muestras y los tubos de alícuotas con dispositivos mecánicos; nunca los decante.
- Los efluentes de los analizadores clínicos deben considerarse contaminados y su desecho debe cumplir con las reglamentaciones estatales y locales.
- Siga las instrucciones del fabricante para la limpieza de rutina y resolución de problemas ante derrames de muestras sobre los instrumentos o en su interior, incluido el PPE apropiado y el tipo de solución de limpieza que se debe usar.
- Cuando las instrucciones del fabricante no incluyan instrucciones para la contención y limpieza de derrames, colabore con el fabricante para crear un SOP que proteja eficazmente al operador y mantenga y amplíe la vida útil del instrumento.
- Se han publicado pautas de seguridad para clasificadores de células (51). Considere agregar lejía al receptáculo de residuos, de modo tal que un receptáculo lleno contendría alrededor de un 10 % de lejía.
3.17.4. Dispositivos de aspiración al vacío (consulte la Sección 3.13.)
3.17.5. Lavadoras de placas para ELISA en microbiología
- Las lavadoras de placas para ELISA pueden crear aerosoles y gotas al agitar el líquido y colocar la superficie del líquido a presión reducida. Las gotas de partículas grandes generadas por los procesos de lavado y aspiración pueden depositar agentes infecciosos en las superficies inmediatas y los aerosoles más finos pueden recorrer distancias mayores y pueden ser inhalados.
- Manipule las placas para ELISA con guantes en todo momento y considérelas como si estuvieran contaminadas.
- Desinfecte las lavadoras de las placas para ELISA y el área que rodea la lavadoras todos los días en que se la use.
- Siempre que sea posible, coloque cubiertas para contención de aerosoles sobre las lavadoras de placas para ELISA a fin de minimizar la contaminación por aerosoles de los trabajadores del laboratorio y el ambiente.
3.17.6. Instrumentos de identificación, hemocultivo y PCR
Los instrumentos para identificación bacteriana y susceptibilidad antimicrobiana, los instrumentos para hemocultivo, los instrumentos para reacción en cadena de la polimerasa (polymerase chain reaction, PCR) y demás instrumentos y dispositivos del laboratorio deben limpiarse y desinfectarse según las instrucciones o recomendaciones del fabricante. Los procedimientos de limpieza de rutina y emergencia de cada instrumento deben formar parte del componente de seguridad del manual de procedimientos.
3.18. Análisis rápidos (kits)
- Cuando se realiza un análisis rápido en el laboratorio o en el lugar de atención, los kits de análisis usados se consideran contaminados y deben desecharse como corresponde.
- Limite el uso de kits de análisis rápido a un área específica del laboratorio, a fin de maximizar la eficiencia de los controles ambientales que pueden prevenir las exposiciones a aerosoles al manipular reactivos, muestras y organismos de control.
- Se recomienda el uso de fundas para superficies desechables, flexibles, con fondo de película de polietileno antideslizantes y muy absorbentes a fin de contener derrames y minimizar la contaminación de los materiales y cajas del kit de análisis.
- Limpie el exterior de los kits de análisis con un desinfectante apropiado de laboratorio antes de volver a guardarlos en el área de almacenamiento.
3.19. Flujo de trabajo unidireccional y separación de las áreas de trabajo
- El área de preparación de reactivos es el área más limpia, seguida por el área de preparación de muestras y, por último, el área de detección de productos.
- Deje los objetos transportables (p. ej., lapiceras, cinta adhesiva, tijeras, cajas de guantes) en cada área designada.
- Cámbiese el delantal y los guantes de laboratorio y lávese las manos antes de entrar a cada área.
- Siga este procedimiento de respuesta ante una emergencia si se produce una liberación de aerosol potencialmente infeccioso fuera de un BSC.
— Todas las personas deben abandonar inmediatamente la unidad de laboratorio en la que se produjo el derrame.
— Las personas expuestas deben ser derivadas para recibir asesoramiento y evaluación médicos
— Informe la situación al supervisor del laboratorio y al encargado de bioseguridad de inmediato.
— Nadie debe entrar a la sala durante al menos 30 minutos a fin de permitir que los aerosoles se dispersen y las partículas más pesadas se asienten.
— Si el laboratorio no tiene un sistema central de extracción de aire, se debe posponer aun más el ingreso (p. ej., hasta 24 horas).
— Coloque carteles que indiquen que está prohibido el ingreso.
— Después del tiempo adecuado, proceda con la descontaminación, supervisado por el encargado de bioseguridad. Debe usarse el PPE apropiado, que puede incluir mascarillas.
4. Laboratorio de tuberculosis
La tuberculosis (TB) producto de una exposición a aerosoles infecciosos sigue siendo uno de los principales riesgos para el personal de laboratorio. No existe un nivel seguro de exposición, ya que la exposición a apenas 1 a 10 organismos puede provocar la enfermedad. Se calcula que entre el 8 % y el 30 % del personal de laboratorio podría experimentar conversiones de tuberculina (52). Para reducir las exposiciones a Mycobacterium tuberculosis, se debe emplear una jerarquía de controles, que incluya prácticas laborales seguras, el uso de equipos de contención e instalaciones de laboratorio especialmente diseñadas (1). Los laboratorios de tuberculosis deben estar separados y aislados del laboratorio de microbiología principal. Desarrolle todas las políticas y prácticas relacionadas con la seguridad usando un proceso de evaluación de riesgos que esté documentado en el manual de bioseguridad del laboratorio.
- Es responsabilidad del director del laboratorio asegurarse de que todos los empleados nuevos reciban capacitación de seguridad que incluya prácticas de manipulación correctas y seguras, uso del equipo de seguridad, como el gabinete de seguridad biológica (BSC), equipo de protección personal (PPE), procedimientos de descontaminación, limpieza de derrames, uso del autoclave, desecho de residuos, conocimiento de los síntomas de la enfermedad por tuberculosis e informes de enfermedades y exposiciones.
- Más importante aun es que se debe supervisar la adhesión a las prácticas de bioseguridad y se debe completar una evaluación anual de competencia.
- Los empleados y la gerencia del laboratorio deben conocer los componentes de ingeniería del laboratorio de TB, como cuántos intercambios de aire hay por hora, cómo se mide la presión negativa, si las puertas se bloquean automáticamente y cómo funciona el intercomunicador de la sala.
4.1. Recepción de muestras y estación de registro/preparación
En la mayoría de los laboratorios clínicos, las muestras se reciben primero en el laboratorio de microbiología principal (nivel de bioseguridad [BSL] 2), donde registran y procesan para otros análisis bacteriológicos. Las muestras enviadas para análisis de TB pasan al laboratorio de TB para continuar el procesamiento específico para la TB.
4.1.1. Recepción de muestras en el laboratorio de microbiología principal
- Se recibe una amplia variedad de muestras para análisis de tuberculosis, entre las que se incluyen esputo, orina, tejido, líquido cefalorraquídeo y lavados gástricos.
- Los procedimientos con muestras clínicas que no producen aerosoles se pueden realizar en un laboratorio BSL-2. La propagación y manipulación de cultivos se realizan en el laboratorio BSL-3.
- Todas las muestras clínicas enviadas específicamente para análisis de TB deben ser manipuladas por personas con PPE que incluya bata y guantes de laboratorio, y el trabajo se debe realizar en un BSC (53) que se certifique por lo menos una vez al año.
- Antes de abrir un recipiente con una muestra para TB, independientemente de la presencia de contaminación visible, desinfecte el exterior pasando una gasa empapada con un desinfectante para tuberculosis.
- Lleve las muestras al laboratorio de tuberculosis, donde todos los procedimientos para descontaminación de muestras de TB, propagación de cultivos y la subsiguiente manipulación de los cultivos se realizan en instalaciones BSL-3 y con el uso de equipo y prácticas de contención y protección respiratoria (1). Se debe dar el mantenimiento adecuado a las instalaciones de BSL-3, y la puerta del laboratorio se debe mantener cerrada.
- Reformar instalaciones BSL-2 para adaptarlo a un laboratorio BSL-3 no es una opción en algunas instalaciones que deben analizar la presencia de M. tuberculosis. En Bioseguridad en laboratorios microbiológicos y biomédicos (BMBL-5) (1) se eliminó el texto que sugería que los procedimientos de BSL-3 se podrían realizar en un laboratorio BSL-2 cuando se trabaja con M. tuberculosis si se usaba un BSC y se ventilaba el aire hacia el exterior del edificio. Se recomienda que esta alternativa se use en laboratorios sin instalaciones BSL-3 únicamente si se pueden documentar tres condiciones: 1) mediante una evaluación de riesgos, se determina que el trabajo con M. tuberculosis se puede realizar de forma segura en un laboratorio BSL-2 separado y cerrado con prácticas y procedimientos de BSL-3; 2) el aire de la sala del laboratorio se ventila al exterior del edificio y 3) el director del laboratorio aprueba la práctica. Si no se puede cumplir alguna de esas condiciones, se recomiendan instalaciones BSL-3 para la manipulación de cultivos.
4.1.2. Recepción de muestras en otras secciones del laboratorio
- Al procesar muestras en las que se sospecha de tuberculosis en una sala de patología quirúrgica, use una mascarilla para partículas N95 durante el seccionamiento por congelación. No utilice propulsor para la liofilización súbita de tejidos.
- Al realizar procedimientos de autopsia, las sierras para hueso deben tener un dispositivo de vacío para minimizar la dispersión de hueso pulverizado. Si se sospecha tuberculosis, use una mascarilla para partículas N95 o una mascarilla con purificador de aire motorizado (powered air-purifying respirator, PAPR) durante el procedimiento, y no se la quite hasta que haya pasado suficiente tiempo desde el procedimiento para la eliminación eficaz de partículas transportadas por el aire mediante el sistema de ventilación, como se indica en el manual de bioseguridad del laboratorio.
4.1.3. Recipientes con fugas
- Recolecte las muestras a procesar en un recipiente a prueba de fugas y transporte las muestras al laboratorio en una bolsa de plástico sellable a prueba de fugas. Un recipiente adecuado garantiza que se pueda iniciar la manipulación de la muestra sin contaminación externa.
- La bolsa de transporte se abre dentro de un BSC para protegerse contra la creación de aerosoles, pulverizaciones y salpicaduras.
4.1.4. Contaminación visible en el exterior del recipiente
- Las muestras que presenten fugas durante el transporte se deben rechazar, y se debe solicitar una nueva muestra. Antes de abrir la bolsa de transporte, observe la muestra para detectar si hay fugas.
- Si el exterior del recipiente está visiblemente contaminado con el contenido del recipiente, rechace la muestra, documente el rechazo y solicite otra muestra.
- Cuando el examen del exterior del recipiente de la muestra presente contaminación menor o superficial del recipiente, limpie el exterior con un desinfectante adecuado antes de seguir manipulándolo.
- Abra con cuidado un recipiente con una muestra, porque esta puede esparcirse o salpicar y contaminar el exterior del recipiente.
- Limpie el exterior del recipiente con una gasa empapada en desinfectante para tuberculosis después de quitar y volver a colocar las tapas.
4.2. Manchas y desecho
Prepare los frotis en un BSC porque se pueden generar aerosoles, gotitas y salpicaduras. Los frotis sin tinción pueden contener bacilos de tuberculosis viables y se deben manejar con precaución.
4.2.1. Tinción de Gram
Las muestras enviadas para cultivos de rutina, en especial esputo y otras muestras respiratorias, pueden contener bacilos de tuberculosis y se deben manipular con cuidado independientemente de que se hayan solicitado cultivos de bacilos ácido-alcohol resistentes (acid-fast bacillus, AFB) o no.
4.2.2. Tinciones para ácido-alcohol resistencia: Kinyoun, Ziehl-Neelsen, auramina–rodamina (fluorescente)
- Antes de retirar los frotis del BSC, fije por calor el portaobjetos en un calentador de portaobjetos eléctrico con la temperatura entre 65 y 75 °C (149 y 167 °F) durante 2 horas. Supervise y registre la temperatura del calentador de portaobjetos cada día de uso. Incluso después de la fijación por calor, el portaobjetos todavía podría contener bacilos de tuberculosis viables y se debe tratar como contaminado.
— En el caso de los laboratorios que no procesen cultivos AFB, pero que deseen hacer un frotis directo, este se puede hacer en el laboratorio BSL-2.
— Se recomienda el uso de una bandeja calentadora de portaobjetos, en lugar de una llama, para la fijación de los portaobjetos. La licuefacción y concentración de esputos para la tinción para ácido-alcohol resistencia se pueden realizar de forma segura en la mesa abierta, tratando primero las muestras en un BSC con un volumen igual de solución de hipoclorito de sodio al 5 % (lejía doméstica sin diluir) y esperando 15 minutos antes de procesar (1).
4.3. Lectura de cultivos y actividades aceptables en la mesa abierta
- Solamente las actividades que son exclusivamente de observación y no implican riesgo de creación de aerosoles se pueden realizar en la mesa abierta. Cualquier manipulación de colonias de crecimiento se realiza dentro del BSC (54). Solamente los recipientes cerrados que no sean de vidrio y contengan cultivos, cuyo exterior esté correctamente desinfectado, se pueden sacar del BSC para realizar lecturas en el espectrofotómetro u otras lecturas de observación. Sin embargo, se prefiere que todo el trabajo con cultivos se realice dentro de un BSC certificado.
- Debe haber procedimientos implementados para abordar la posibilidad de rotura de los cultivos (consulte la Sección 4.7, Limpieza de derrames). Los cultivos viables se deben transportar en forma segura con soportes, transportadores de seguridad y/o carros para evitar roturas.
- Las superficies de trabajo se deben desinfectar todos los días en que se realicen análisis en el laboratorio.
4.4. Precauciones personales y prácticas laborales
Las precauciones y las prácticas laborales se seleccionan en función de la cantidad potencial de bacilos de tuberculosis encontrados en el procedimiento que se está realizando. Por lo tanto, las muestras tienen una concentración más baja que un cultivo, en el que la cantidad de organismos está amplificada. Debido a que se generan aerosoles siempre que se imparte energía a la muestra, todos los protocolos del laboratorio de TB se evalúan mediante el proceso de evaluación de riesgo del potencial de generar aerosoles. Los procedimientos comunes que generan aerosoles son verter cultivos líquidos y líquidos de sobrenadante, usar pipeteadores automáticos de volumen fijo y mezclar cultivos líquidos con una pipeta.
- El personal de laboratorio que manipule muestras en las que M. tuberculosis sea el patógeno sospechoso y/o realice análisis de diagnóstico de M. tuberculosis se debe someter a por lo menos un análisis anual de infección por tuberculosis. Esto se puede hacer mediante una prueba cutánea de tuberculina (tuberculin skin test, TST) o un ensayo de liberación de interferón gamma (interferon gamma release assay, IGRA). Si se realiza la TST, se utiliza un proceso de dos pasos en el momento de la contratación y se continúa a partir de ese momento con una TST de un paso. Es posible que se necesite un análisis de detección de TB más frecuente si se produce un incidente en el laboratorio con riesgo de exposición a tuberculosis o si ocurre una conversión documentada. No realice una TST si el empleado tiene antecedentes de haber recibido una vacuna BCG o tiene una TST anterior positiva, en cuyo caso, se deberá realizar un IGRA.
- El personal debe estar consciente de que ciertos cambios en la salud, p. ej., recibir quimioterapia, pueden aumentar su riesgo de infectarse con tuberculosis si se produce una exposición.
4.4.1. Equipo de protección personal
- Una bata desechable con frente sólido y puños ajustados (tejidos) se usa de forma rutinaria como protección contra las pulverizaciones y las salpicaduras.
- Se deben usar guantes en todo momento al trabajar en instalaciones BSL-3, y estos deben ser lo suficientemente largos para superponerse externamente a las mangas de la bata. En el entorno BSL-2, el uso de guantes depende de la práctica de rutina del laboratorio guiada por una evaluación de riesgos.
— En general, se usan guantes siempre que exista un riesgo razonable de contaminación de la piel por pulverización, salpicaduras o gotitas durante procedimientos que generan aerosoles. Los guantes se usan desde el momento inicial del trabajo, cuando se observa el exterior del recipiente para detectar contaminación externa.
— No es necesario usar guantes cuando se observan cultivos fuera del entorno BSL-3. - Como práctica laboral de rutina, el empleado de laboratorio se debe quitar todas las prendas protectoras al salir del laboratorio. Independientemente de si se usen guantes o no, es necesario lavarse las manos minuciosamente después de completar los procedimientos.
4.4.2. Protección respiratoria
- Es muy recomendable usar una mascarilla, como una N95, para proteger a los empleados del laboratorio cuando procesan y manipulan muestras o cultivos de TB. Las mascarillas quirúrgicas son menos eficaces porque están diseñadas para contener los aerosoles que expele el usuario, no para protegerlo de los aerosoles. El personal debe ser evaluado médicamente y se debe realizar una prueba de ajuste antes de usar una mascarilla N95. Si no se puede hacer una prueba satisfactoria de ajuste de una mascarilla N95 (p. ej., una persona con vello facial), una alternativa aceptable es el PAPR.
- Ningún BSC es 100 % eficaz. Sí se producen fallas, y las mascarillas ofrecen protección adicional.
- El personal que trabaja en el laboratorio de TB debe seguir el programa de protección respiratoria de las instalaciones que cumpla con los requisitos de la OSHA (55).
— Los componentes del programa de protección respiratoria son un procedimiento operativo estándar escrito, capacitación, almacenamiento de la mascarilla si se volverá a utilizar, inspección de la mascarilla antes de usarla, revisión médica y evaluación del programa.
— La elegibilidad para participar en el programa de la mascarilla incluye una revisión médica y una prueba de función pulmonar.
— Antes de usarla, se debe hacer una prueba de ajuste de la mascarilla para determinar el tamaño de la mascarilla que mejor se ajuste al trabajador y que garantice un cierre hermético sobre la cara.
— La prueba anual de ajuste es una oportunidad para que el personal demuestre cómo colocarse adecuadamente la mascarilla. - Los técnicos de servicio externos también deben cumplir con los requisitos de PPE para el personal del laboratorio. No permita que se realicen reparaciones, limpieza o revisiones del equipo en instalaciones BSL-3 a menos que un técnico capacitado o un profesional esté presente para garantizar que se sigan las precauciones de seguridad adecuadas.
- El PPE utilizado en el laboratorio BSL-3 se debe retirar antes de salir del laboratorio. Las manos se deben lavar siempre minuciosamente después de quitarse el PPE. Asimismo, el PPE utilizado en el laboratorio BSL-2 se debe quitar antes de salir del laboratorio. Las batas de laboratorio usadas durante el trabajo en el laboratorio nunca se usan fuera del laboratorio.
4.5. Desinfección
- El desinfectante para el laboratorio de TB se selecciona en función de su actividad contra la tuberculosis y su clasificación con un nivel de actividad intermedia (1). Los compuestos seleccionados generalmente son compuestos fenólicos, yodóforos, de cloruro o alcoholes. El tiempo de eliminación de organismos de los germicidas nunca es instantáneo, y se deben tener en cuenta los tiempos de exposición y la matriz del material contaminado al elegir un desinfectante adecuado.
- La desinfección diaria de todas las superficies del laboratorio de TB es necesaria porque M. tuberculosis es muy resistente al secado y puede sobrevivir durante largos periodos sobre superficies sólidas.
- Una buena práctica de desinfección es empapar un paño de gasa o una toalla de papel en desinfectante y colocarlo en la superficie de trabajo dentro del BSC mientras se procesan las muestras.
- Al decantar líquidos en el BSC, use un recipiente a prueba de salpicaduras. Se debe agregar desinfectante al recipiente a prueba de salpicaduras antes de usarlo. Si el recipiente a prueba de salpicaduras tiene un embudo, enjuáguelo con desinfectante después de usarlo.
- Use un dispositivo incinerador de asas o un matraz para alcohol y arena para retirar cúmulos grandes de organismos de asas de alambre o palas.
4.6. Descontaminación y desecho de residuos de laboratorio
- Coloque un autoclave en el laboratorio de micobacteriología, de modo que los residuos generados se puedan esterilizar antes de transportarlos desde el laboratorio. Cumpla los procedimientos programados de control de calidad y mantenimiento del autoclave.
- Si no se dispone de un autoclave o en el caso de objetos que no se pueden esterilizar mediante autoclave, todos los residuos del laboratorio de micobacteriología deben estar contenidos de forma segura en recipientes a prueba de fugas. Empaque los residuos de forma que el exterior del recipiente se pueda desinfectar antes de que salga del laboratorio.
- Desinfecte químicamente los materiales de desecho antes de sacarlos del BSC.
4.7. Limpieza de derrames
- La respuesta en caso de derrame depende de la cantidad de aerosoles producidos. La decisión de seguir un procedimiento de respuesta a un derrame mínimo o importante de aerosol se toma junto con el supervisor y el responsable de seguridad, y conforme al manual de bioseguridad (Tabla 6).
— Si la cantidad de aerosoles producidos es mínima, como por el derrame de una muestra, cubra el derrame con toallas de papel absorbentes y abundante desinfectante contra la tuberculosis. Abandone el laboratorio hasta que al menos el 99 % de las partículas transportadas por el aire hayan sido eliminadas (Tabla 6), según lo determine el responsable de seguridad. Deje el desinfectante sobre el derrame hasta volver a ingresar. Desinfecte los pisos y las superficies de encimeras.
— En caso de un derrame que produzca una cantidad importante de aerosoles o de rotura, como un cultivo líquido que contiene M. tuberculosis, evacue inmediatamente el laboratorio. Nadie puede volver a entrar al área hasta que se hayan producido suficientes intercambios de aire para eliminar 99 % - 99,9 % de núcleos en gotas del ambiente, según lo determine el responsable de seguridad usando la orientación de la Tabla 6. El supervisor o el responsable de seguridad podrían determinar que es necesario descontaminar el laboratorio con gas de formaldehído u otro agente. Se debe usar una protección adecuada con mascarilla y otro PPE para limpiar derrames o material roto. No levante vidrios rotos con las manos.
4.8. Áreas limpias en comparación con áreas sucias del laboratorio
- En el área de trabajo del laboratorio no debe haber objetos que obstruyan el paso, y su disposición debe ser tal que el flujo de materiales vaya de un área limpia a un área sucia del laboratorio.
- Dentro del BSC, el área inmediata de trabajo debe estar cubierta con un paño empapado en desinfectante contra la tuberculosis para capturar cualquier gotita o salpicadura que pudiera producirse por la manipulación de la muestra, las pipetas, las asas, los tubos, los portaobjetos u otros instrumentos. Si el paño de gasa se seca durante los procesos de trabajo, vuelva a humedecerlo.
4.9. Hemocultivos AFB
- No procese la sangre enviada para análisis de micobacterias junto con los hemocultivos de rutina. La muestra preferida es sangre entera. Se debe procesar en un laboratorio BSL-3.
- Si es necesario procesar un hemocultivo de rutina para detectar micobacterias, realice todo el trabajo con un hemocultivo positivo en instalaciones BSL-3.
4.10. Instrumentación
- Se necesita una centrífuga a prueba de aerosoles con rotor con protección de seguridad para la centrifugación de una muestra que pueda contener bacilos de tuberculosis.
- Descontamine los tubos con muestras y colóquelos en pocillos de seguridad convexos sellados con anillos “O” dentro del BSC antes de transportarlos a la centrífuga, o coloque los tubos descontaminados en un soporte y llévelos a la centrífuga. Después de la centrifugación, mantenga los tubos sin abrir en el transportador hasta que estén dentro del BSC; luego, decántelos en un recipiente a prueba de salpicaduras.
- Instale un lavabo equipado con una llave con detección automática de movimiento o con controles para la rodilla o el pie.
4.11. Pruebas
4.11.1. Análisis rápidos (kits de análisis molecular directo)
- Realice todo el trabajo en un laboratorio BSL-3 y dentro del BSC.
- Una vez que la muestra en la que se realizará un análisis rápido haya sido inactivada o se haya extraído el material genético, el resto de los análisis se pueden realizar en un laboratorio BSL-2.
4.11.2. Análisis molecular
- Todo el trabajo que implique procesar muestras en las que se sospecha la presencia de bacilos de tuberculosis y la manipulación de cultivos micobacterianos se debe realizar en un laboratorio BSL-3 y dentro del BSC.
- Una vez que la muestra en la que se realizará un análisis molecular haya sido inactivada o se haya extraído el material genético, el resto de los análisis se pueden realizar en un laboratorio BSL-2.
5. Autopsia/necropsia, patología quirúrgica
- Autopsia (examen de cadáver humano). Los riesgos de infección y peligro para el trabajador de laboratorio que realiza una autopsia son mayores que los riesgos para cualquier otro profesional de la atención médica, debido a los procedimientos usados, la población que se evalúa y la realización del trabajo en un área abierta. El uso de escalpelos, sierras y agujas, así como la exposición a objetos cortopunzantes dentro del cuerpo, fragmentos óseos, metal fracturado y/o agujas pueden producir cortes y lesiones percutáneas. La manipulación de órganos grandes que produce salpicaduras de fluidos corporales y sangre, y el uso de instrumentos como mangueras y sierras, crea aerosoles en un área abierta, lo que puede ocasionar la inhalación, el contacto directo o el contacto con objetos contaminados en el ambiente. Las personas involucradas directamente en la autopsia, así como las otras personas presentes en la sala, tienen riesgo de exposiciones. Otros riesgos posibles para la seguridad incluyen la exposición a sustancias químicas como la formalina, esferas de radiación terapéutica y herramientas eléctricas retenidas. Un trabajador alerta y bien capacitado, un buen diseño de las instalaciones, equipo de protección personal (PPE) con un ajuste óptimo y fácil de utilizar, procedimientos quirúrgicos adecuados durante la manipulación del cuerpo y el material disecado y los procedimientos subsiguientes de desinfección y esterilización son todos fundamentales para minimizar el riesgo de bioseguridad durante la autopsia y embalsamamiento.
- Necropsia (examen de cadáver animal). El riesgo de contraer una infección adquirida en el laboratorio es muy distinto cuando se trabaja con cadáveres humanos (donde los agentes infecciosos de prácticamente todos los cadáveres son infecciosos para los humanos) en comparación con los cadáveres animales (donde los agentes infecciosos de la mayoría de los cadáveres no son patógenos humanos). Independientemente de eso, los cadáveres animales pueden albergar agentes zoonóticos, y la evaluación de riesgos para determinar si puede haber agentes zoonóticos infecciosos presentes en un cadáver, como se resume en la Sección 12, es de vital importancia para establecer procedimientos de bioseguridad adecuados para una necropsia animal. Las pautas de esta sección son mejores prácticas de bioseguridad combinadas tanto para la autopsia humana y la patología quirúrgica humana como para la necropsia animal y la patología quirúrgica veterinaria. Cuando es necesario, se destacan las pautas de bioseguridad específicas para un laboratorio de diagnóstico para humanos o un laboratorio de diagnóstico para animales.
5.1. Autopsia/necropsia: infecciones asociadas
La fuente de la mayoría de las infecciones adquiridas en el laboratorio y las exposiciones peligrosas que ocurren durante una autopsia/necropsia se desconoce, y todas las autopsias y necropsias se deben considerar riesgosas (1,56).
- Las instalaciones para autopsias humanas funcionan de la forma más segura con un nivel de bioseguridad 3 (BSL-3) para la protección óptima de los involucrados directamente en la autopsia y del personal del área circundante (1,56–58). Si no se dispone de instalaciones BSL-3, las autopsias se pueden realizar utilizando las precauciones de barrera de BSL-2 más el flujo de aire negativo y las precauciones respiratorias de BSL-3 (56).
- Las instalaciones para necropsias animales pueden funcionar con BSL-2 con la opción de realizar prácticas de BSL-3 cuando lo exija la evaluación de riesgos en cada caso específico (considerando, por ejemplo, la disponibilidad de un gabinete de seguridad biológica [BSC] clase II, mesas para necropsia con tiro descendente y el PPE adecuado, como protección ocular y facial). Solamente en caso de que una evaluación de riesgos indique que hay una alta probabilidad de presencia de un patógeno de ganado con consecuencias mayores (agente o toxina seleccionado en ganado del USDA [consulte la Sección 12.1]), se requerirían instalaciones BSL-3.
- El director médico o, en caso de necropsia animal, el patólogo tratante, es responsable de la evaluación de riesgos y de considerar procedimientos limitados de autopsia/necropsia y el subsiguiente nivel de riesgo aceptable para el personal antes de cada autopsia/necropsia (1,2,56,59)
- Seleccione un integrante del personal para que reciba capacitación en procedimientos de seguridad y delegue a esa persona la supervisión de los procedimientos de seguridad y el análisis de riesgos en la sala de patología.
5.1.1. Patógenos trasmitidos por la sangre
Los trabajadores de atención médica para humanos involucrados en la realización de autopsias tienen un alto riesgo de adquisición ocupacional de patógenos transmitidos por la sangre debido tanto a las lesiones que reciben como a la población que se somete a autopsia. El riesgo de transmisión más alto es por exposición al virus de la hepatitis B, luego el virus de la hepatitis C y el virus de inmunodeficiencia humana, respectivamente. Esas infecciones se han documentado a partir de autopsias y también durante el embalsamamiento (1,2,56,60–62).
5.1.2. Otras infecciones
Faltan datos específicos sobre otros patógenos transmitidos por la sangre, como citomegalovirus, pero la transmisión infecciosa es posible y el riesgo puede ser más alto, en especial en mujeres embarazadas (serológicamente negativas) o en empleados inmunocomprometidos. Evalúe individualmente a las personas con mayor riesgo de infección y permítales otorgar su consentimiento para participar en la autopsia solamente después de que hayan sido asesorados (2,63).
5.1.3. Aerosoles infecciosos
Las autopsias/necropsias de cadáveres en los que se sospecha la presencia de agentes zoonóticos generan posibles aerosoles infecciosos. Si bien Mycobacterium tuberculosis es el patógeno prototípico que más se ha señalado como patógeno transmitido por aerosolización, otros ejemplos incluyen a personas que contrajeron meningococcemia, ántrax, rickettsiosis y legionelosis. La manipulación de tejido infeccioso puede producir partículas transportadas por el aire de un tamaño (< 5 µm) que flota en corrientes de aire durante periodos prolongados, y que posteriormente pueden llegar a los alvéolos pulmonares y partículas en gotitas pequeñas (> 5 µm) que se asientan más rápidamente. Se puede producir contaminación por mangueras para aspirar líquido, por rociar el cadáver y por sierras oscilantes. Los aerosoles creados permanecen dentro del área de la autopsia y pueden ocasionar el contacto subsiguiente con la boca y los ojos, la inhalación o la ingestión, y pueden contaminar superficies inanimadas como computadoras, teléfonos y equipo de cámaras (56,57).
5.1.4. Organismos que requieren prácticas de seguridad adicionales
- No se ha documentado ningún caso de enfermedad de Creutzfeldt-Jakob (Creutzfeldt-Jakob disease, CJD). Sin embargo, como la partícula prion infecciosa no se puede volver no infecciosa mediante los métodos de descontaminación y esterilización normales, es obligatorio mejorar las precauciones. La transmisibilidad del prion se conserva en bloques de parafina fijados con formalina (64–67).
- La única enfermedad natural por un prion animal con potencial conocido de infección zoonótica es la encefalopatía espongiforme bovina (bovine spongiform encephalopathy, BSE) clásica. Las pautas de necropsia en ganado con sospecha de BSE están publicadas en otros documentos, y se enfocan principalmente en evitar punciones en la piel, reducir las salpicaduras en membranas mucosas, descontaminar las instalaciones y los equipos, y el desecho de las reses muertas (68).
5.1.5. Otras exposiciones de bioseguridad
- Cianuro, fosfuros metálicos y pesticidas organofosforados
— Se requieren precauciones específicas y pueden incluir el uso de una campana de extracción de gases o un BSC clase II tipo B2 con ventilación al exterior, mascarillas para gases, limitar la autopsia/necropsia y limitar el tiempo de exposición (56). - Esferas radiactivas o estudios por imágenes para diagnóstico
— Consulte al responsable designado de seguridad en materia de radiación para conocer las medidas adecuadas recomendadas para limitar la exposición a radiación, la transferencia del cuerpo y el análisis posterior a la exposición del personal. - Peligro para instrumentos eléctricos y de otro tipo (marcapasos, catéteres permanentes)
— Desactive el marcapasos antes de continuar con la autopsia. Si hay un desfibrilador presente, descárguele la corriente eléctrica si es posible. Si hay algún instrumento, se debe registrar y luego retirar para que no provoque lesiones por cortes durante la autopsia.
5.1.6. Informe al director de la agencia funeraria
Informe los patógenos transmitidos por la sangre conocidos o la sospecha de otros peligros por aerosolización al director de la agencia funeraria y a otras personas que posiblemente manipulen el cuerpo, a fin de limitar transmisiones subsiguientes que se podrían producir durante el transporte o el embalsamamiento (69).
5.1.7. Restos de necropsias de animales
Deseche los cadáveres de animales con posibles agentes zoonóticos infecciosos mediante una descontaminación adecuada (p. ej., incineración, digestión alcalina u otros métodos) y no los devuelva a los dueños de los animales para un entierro privado.
5.2. La sala de autopsia/necropsia
5.2.1. Inspeccione el cuerpo
- Busque si hay objetos implantados conservados después de la muerte. Estos se deben registrar y sujetar con pinzas, o se deben cubrir antes del transporte para reducir la salida de fluidos corporales del cuerpo. Limpie el cuerpo si hay sangre o fluidos corporales visibles. Cubra la mesa de autopsia con una sábana de plástico para retener la mayoría de los líquidos o, de forma alternativa, use mesas con drenajes, de forma que los líquidos se puedan acumular en cubetas o drenajes en el piso.
- Deseche adecuadamente los líquidos y los tejidos de necropsias de animales con sospecha de agentes zoonóticos mediante métodos que proporcionen una descontaminación adecuada, según el agente infeccioso específico del que se sospecha (p. ej., incineración, procesamiento de los desechos, elaboración de composta).
5.2.2. Pautas de seguridad para la sala
- Use el símbolo universal de peligro biológico para señalar la sala de autopsia como un área de peligro biológico en la entrada.
- Proteja el acceso a la sala de autopsia y otorgue acceso únicamente al personal capacitado en los procedimientos de bioseguridad específicos de esa área.
- Proteja las mangueras de vacío con purgadores con líquido desinfectante y filtros HEPA o su equivalente.
- Use sierras manuales siempre que sea posible para reducir los aerosoles. Humedezca los huesos antes de cortarlos. El patólogo puede optar por el uso de sierras oscilantes para huesos con dispositivo de vacío; en lo posible, úselas en un área cerrada. Estos dispositivos de vacío son difíciles de mantener limpios y se deben manipular como un posible riesgo de infección. Cubra con toallas cualquier borde serrado de hueso que quede expuesto. Al cortar el cráneo durante una autopsia, si se sospecha la presencia de priones, coloque la cabeza en una bolsa.
- No deje agujas usadas en la mesa. No desconecte ni vuelva a envainar las agujas. Deseche la unidad entera en recipientes para objetos cortopunzantes. Asegúrese de que haya recipientes para objetos cortopunzantes en el área de trabajo, e inspecciónelos periódicamente para asegurarse de que nunca estén llenos a más de dos tercios. Ciérrelos herméticamente y reemplácelos cuando alcancen ese nivel.
- Limite la cantidad de personas que trabajan en el cuerpo humano al mismo tiempo al prosector y/o al médico y circulante. Permita solamente a una persona hacer cortes por vez. Se debe aplicar la misma limitación de cantidades a la necropsia de animales pequeños. La necropsia de animales grandes por lo general requiere múltiples prosectores trabajando en conjunto, de forma tal que se eviten las laceraciones accidentales.
- Prepare múltiples escalpelos antes de la autopsia para evitar los cambios de cuchillas con las manos resbaladizas y contaminadas. De forma alternativa, cámbiese los guantes externos antes de cambiar las cuchillas. Use tijeras de bordes romos cuando sea posible en lugar de escalpelos, y use un imán para recoger los instrumentos de la mesa si estos están resbaladizos.
- No le alcance objetos cortopunzantes, como escalpelos o tijeras, a otra persona. Colóquelos sobre la mesa para que la otra persona los tome.
- Coloque los recipientes con muestras (p. ej., frascos de hemocultivos) en una superficie limpia para la inoculación. Si es posible, use un soporte. No los sostenga con las manos mientras esté inoculando.
- El examen de los órganos del cuerpo y la técnica de evisceración se debe considerar para limitar la exposición a la sangre, los fluidos corporales y cortes.
- Con el tejido no fijado que se retirará de la mesa de autopsia, haga lo siguiente.
— Colóquelo en una bandeja o cubeta para evitar salpicaduras o el goteo de líquidos.
— Después de examinar, cortar y/o tomar fotografías, devuelva el tejido a la mesa de autopsia para volver a colocarlo en el cuerpo y/o fijarlo.
— Coloque las muestras que se enviarán para cultivo u otros análisis de laboratorio en un recipiente primario cuya superficie exterior esté descontaminada, colóquelo en un recipiente secundario a prueba de fugas y rotúlelo como peligro biológico.
— Los órganos grandes se deben extraer y cortar en múltiples secciones (en rebanadas) para lograr la permeabilidad adecuada del tejido para su fijación.
— El tejido no fijado que no se devolverá al cuerpo se considera un residuo con peligro biológico y se debe mantener al mínimo, desechándolo posteriormente de una manera que permita la descontaminación adecuada.
— En una autopsia, cierre el cuerpo con suturas o grapas. Al suturar, sostenga los colgajos de piel con fórceps, no con las manos.
— Revise si hay algún tejido no fijado que requiera el uso de PPE como el que se utiliza en la autopsia. - Use dispositivos de grabación de manos libres o activados con pedal durante el dictado, y un teléfono manos libres con altavoz para minimizar la contaminación de las superficies inanimadas.
- Proporcione un lavabo de manos libres a la salida para lavarse.
- Proporcione una estación de lavado de ojos y una ducha (2).
5.3. Sustancias químicas (formaldehído)
El formaldehído (3,7 % - 4,0 %) usado para la conservación de muestras es la sustancia química tóxica más frecuente a la que están expuestas las personas que realizan autopsias. La sustancia química es volátil y tóxica y causa irritación en los ojos, membranas mucosas y piel y se asocia con un aumento del riesgo de todo tipo de cánceres. Las reglamentaciones de la Administración de Seguridad y Salud Ocupacionales (OSHA) especifican un límite de exposición de 0,75 ppm como un promedio ponderado por tiempo de 8 horas, y 2,0 ppm para exposiciones breves (15 minutos) (70). Si el olor del formaldehído es detectable, probablemente implique que se está produciendo una exposición a una concentración que supera los límites aceptables.
Limite la exposición a formaldehído de la siguiente manera.
- Cubra todas las cubetas con muestras en las que se puedan depositar órganos para su fijación.
- Recopile todas las toallas y otros residuos empapados en formalina en una bolsa en la mesa de examen macroscópico. Pulverice periódicamente un agente neutralizador de formalina sobre los residuos a medida que se llena la bolsa. Cierre la bolsa herméticamente cuando esté llena.
- Deseche las toallas y otros residuos empapados en formalina guardados en la bolsa en un recipiente recubierto que se pueda abrir y cerrar con pedal.
- Corte los órganos grandes fijados en una campana de extracción de gases o una mesa con drenaje.
- Supervise a los trabajadores y patólogos residentes con placas de vigilancia de formaldehído durante periodos de 8 horas y periodos de por lo menos 15 minutos periódicamente, a fin de evaluar la exposición a formaldehído.
- Asegúrese de que los encargados de examen macroscópico de tejidos sean competentes en la técnica de examen macroscópico de tejidos.
5.4. Derrames
- Use tapetes neutralizantes y absorbentes para los derrames pequeños. Los reactivos neutralizantes aportan un método práctico y eficaz en función de los costos de desechar soluciones peligrosas de formaldehído, glutaraldehído y otras soluciones de aldehídos. Estos convierten a los aldehídos peligrosos en agua y polímeros no peligrosos, no corrosivos y no tóxicos. El polímero producido no es un residuo peligroso, según la definición del Título 40 del Código de Reglamentaciones Federales (Code of Federal Regulations, CFR) de los EE. UU. (71). Esos agentes neutralizantes tienden a reducir los costos de la eliminación de residuos y contribuyen a que el ambiente de trabajo sea más seguro. En algunos casos, después del tratamiento de residuos de formaldehído con productos de cristal, el residuo sólido resultante puede desecharse mediante los flujos aprobados para residuos sólidos de laboratorio.
- Use guantes protectores y ropa protectora adecuados para evitar la exposición de la piel. Use gafas protectoras o gafas de seguridad para sustancias químicas, o bien use protectores faciales completos, como se describe en las reglamentaciones de protección ocular y facial de la OSHA (72).
5.5. Equipo de protección
5.5.1. Equipo de seguridad
- Los gabinetes de seguridad biológica (2,56) no son frecuentes en las salas de autopsia debido a sus limitaciones para adaptarse al volumen y tamaño del material que se manipula.
- Use instalaciones de necropsia equipadas con BSC clase II cuando sea práctico (con animales pequeños) para realizar necropsias de cadáveres con sospecha de agentes zoonóticos, según lo indique el análisis de riesgos en cada caso. No obstante, dado que la necropsia de cadáveres de animales grandes con agentes zoonóticos sospechados no es posible en un BSC, utilice PPE, controles de ingeniería y procedimientos que hayan sido elaborados específicamente para laboratorios clínicos.
- Para una protección óptima cuando hay riesgo conocido de exposición a patógenos transmitidos por la sangre y a agentes transmitidos por aerosoles, todas las instalaciones para autopsia/necropsia deben poder aplicar prácticas laborales de BSL-3 y contención física, o bien derivar el trabajo a instalaciones que puedan hacerlo (56,59).
- Proporcione flujo de aire unidireccional de las áreas limpias a las áreas sucias.
- Asegúrese de que la sala tenga presión negativa en relación con las salas que la rodean, con 11 a 12 intercambios de aire por hora.
- El aire puede ventilarse directamente al exterior o volver a circular por la sala a través de filtros HEPA, pero no permita que el aire vuelva a circular hacia ninguna área limpia circundante porque eso se ha asociado con brotes de infección por M. tuberculosis.
- En caso de rediseñar la sala de autopsia/necropsia, considere la colocación de un BSC para mitigar la exposición a tejidos infecciosos (56,73).
5.5.2. PPE para personal de autopsias/necropsias
- Indumentaria
— Traje entero o camisa y pantalones de material resistente a líquidos (quirúrgico) y que cubra del cuello a los pies y los brazos
— Delantal a prueba de agua y mangas a prueba de agua
— Calzado cerrado cubierto con fundas o protectores para calzado a prueba de líquidos
— Gorro o capucha quirúrgica que cubra la cabeza por completo (autopsia únicamente) - Protección de salpicaduras y aerosoles
— En una autopsia general o en una necropsia cuando la evaluación de riesgo indica una alta probabilidad de agentes zoonóticos en el cadáver y la necropsia no puede realizarse en un BSC, use un protector facial transparente que cubra los ojos, la boca y el cuello y colóquese una mascarilla N95 para la que haya realizado una prueba de ajuste. Las gafas y los lentes de contacto por sí solos no son adecuados para la protección.
— Las personas que no puedan usar mascarillas N95 deben usar mascarillas purificadoras de aire automáticas (PAPR).
— Las mascarillas quirúrgicas no protegen a los participantes de una autopsia de inhalar contaminantes transportados por el aire, como aerosoles infecciosos respirables o vapores químicos peligrosos. (56,57,69,73,74). - Guantes
— Se recomienda usar guantes dobles durante toda la autopsia/necropsia y cambiar los guantes a cada hora. El 8 % de los guantes se perforan por una punción durante una autopsia, y alrededor de un tercio de las punciones permanecen sin ser detectadas hasta después de que los guantes se quitan (56,75).
— En la autopsia, seleccione un guante resistente a cortes de malla de acero tejido para evitar los cortes producidos por huesos y escalpelos, y cúbralo con un guante de goma para tener resistencia antideslizante. Los guantes resistentes a cortes no lo protegen contra las punciones con agujas.
— Seleccione guantes específicos para la tarea y circunstancias determinadas. Por ejemplo, use guantes gruesos para exposición a sustancias químicas o guantes que resistan punciones accidentales si se usarán agujas.
— Cámbiese los guantes inmediatamente después de detectar una punción, lávese las manos con agua y jabón antes de continuar con la autopsia/necropsia. - Cubra los cortes o abrasiones con vendajes oclusivos a prueba de agua.
- Proporcione PPE al personal presente pero que no participe directamente en la autopsia, es decir, estudiantes de medicina/observadores. Los observadores deben usar el mismo PPE que los encargados de realizar la autopsia/necropsia.
- Todas las superficies deben considerarse como contaminadas.
5.6. Procedimientos de desinfección y limpieza para el equipo y los instrumentos
5.6.1. Autopsia humana
- Limpie cualquier derrame de fluidos corporales o tejidos inmediatamente. Cubra el derrame con toallas de papel y sature el área con una solución desinfectante o detergente, o use un trapeador seguido de desinfección del área del derrame con una solución 1:10 de lejía.
- Para la descontaminación del cuerpo después de la autopsia, lávelo con una solución detergente, seguida de una solución antiséptica o de lejía diluida. Coloque el cuerpo en una mortaja a prueba de fugas y rotúlelo como peligro biológico. Se debe notificar directamente al director de la agencia funeraria en caso de la presencia de patógenos conocidos transmitidos por la sangre o de M. tuberculosis.
5.6.2. Autopsia humana/necropsia animal
Las siguientes pautas para la desinfección y limpieza tras una autopsia o necropsia se aplican a ambos tipos de procedimientos.
- Toda persona involucrada con el cuerpo, la sala o la limpieza de los instrumentos debe usar el PPE apropiado.
- Lave todas las superficies de trabajo y pisos con una solución detergente seguida de desinfección con una solución 1:10 de lejía u otro desinfectante comercial apropiado.
- Retire el tejido macroscópico visible de los instrumentos no desechables (mangos de cuchillas, cubetas, delantales) antes de la desinfección química o en autoclave. Coloque los objetos cortopunzantes en recipientes resistentes a punciones y lávelos con una solución detergente para eliminar cualquier resto de tejido macroscópico. Enjuáguelos con agua y sumérjalos por completo en una solución 1:10 de lejía o un desinfectante comercial apropiado; el volumen dependerá de la cantidad de sangre y fluidos corporales presentes. Tenga en cuenta que la lejía corroe los dispositivos de acero inoxidable y aluminio. Elimine el desinfectante o la lejía enjuagando los elementos con agua.
- Coloque los objetos desechables, productos de papel, delantales, esponjas y otros similares en un recipiente o bolsa para residuos con peligro biológico para el tratamiento terminal o en el autoclave.
- Coloque la indumentaria reutilizable en una bolsa a prueba de fugas para residuos con peligro biológico destinados a la lavandería, según el protocolo del hospital.
-
Lave los objetos reutilizables que no se pueden lavar en la lavandería, como los delantales, con una solución de detergente, descontamínelos con una solución de lejía, enjuáguelos con agua y déjelos secar antes del siguiente uso.
- No se deben sacar de la sala objetos sucios ni nada utilizado en la autopsia, incluida la indumentaria y las batas de laboratorio.
- Mantenga la cámara, teléfonos, teclados de computadoras y demás objetos lo más limpios posibles, pero considérelos como contaminados y tóquelos con guantes. Limpie los objetos con una solución detergente y una solución 1:10 de lejía o un desinfectante apropiado después de cada uso.
- Lávese las manos con agua y jabón después de quitarse los guantes al salir de la sala.
5.7. Gestión de residuos
5.7.1. Tejido humano
Se deben incinerar todos los residuos patológicos, ya que se consideran materiales peligrosos y están regulados por el Departamento de Transporte (Department of Transportation, DOT) de EE. UU., o transpórtelos a una planta de tratamiento dentro o fuera de las instalaciones en recipientes o carros exclusivos para este fin, a prueba de fugas y claramente rotulados, que cumplan los requisitos del DOT. Los recipientes para residuos cortopunzantes del DOT deben ser a prueba de punciones además de cumplir esos requisitos. También pueden aplicar reglamentaciones estatales, locales y regionales y deben ser tenidas en cuenta.
5.7.2. Tejido animal
Deseche todos los residuos de una necropsia animal (tejidos o el cadáver después de la necropsia) mediante un método adecuado según se determine en la evaluación de análisis de riesgo de cada caso puntual (incineración, autoclave y desecho estándar de los residuos, procesamiento de los desechos, elaboración de composta, cremación, entierro privado).
5.7.3. Otros residuos
Triture los residuos de las bolsas rojas que pasaron por el autoclave, si corresponde. También pueden aplicar reglamentaciones estatales, locales y regionales y deben ser tenidas en cuenta. (Consulte la Sección 3.5, Gestión de residuos.)
5.8. Áreas limpias en comparación con áreas sucias
Las áreas limpias pueden incluir un área administrativa y baños con duchas. El aire de esas áreas se debe ventilar de forma diferente al aire de la sala de autopsia (56,76,77). Todas las demás áreas se consideran sucias y se requiere el PPE apropiado.
5.9. Patología quirúrgica
- La patología quirúrgica incluye la disección macroscópica y el seccionamiento por congelación. La histología y la citología son áreas “híbridas” de la autopsia y los laboratorios de diagnóstico clínico. Cada sección del laboratorio tiene sus propias cuestiones exclusivas de seguridad; los datos sobre la práctica biosegura estándar o sobre incidentes de bioseguridad informados son muy limitados. La documentación e investigación en materia de seguridad en patología quirúrgica son necesarias para elaborar futuras pautas y recomendaciones (78,79).
- Los riesgos de la patología quirúrgica se asocian con la manipulación de grandes cantidades de tejidos frescos de fuentes infecciosas desconocidas, que pueden producir punciones, cortes y salpicaduras de sangre y fluidos corporales, en forma similar a lo que sucede en una autopsia en la que se deben observar órganos frescos en una mesa de examen macroscópico y se deben cortar en secciones lo bastante finas para su fijación (es decir “en rebanadas”). Otros riesgos incluyen el uso de equipo de corte con criostato o pulverizador para congelación que generan aerosoles infecciosos al seccionar el tejido congelado, y exposiciones a grandes volúmenes de formaldehído.
- El tejido que se usará para examen de los portaobjetos se fija en formalina; posteriormente, pequeñas secciones de tejido de interés se disecan con escalpelos, se colocan en casetes, se vuelven a colocar en tanques para muestras y se transportan a histología.
- En histología el tejido fijado en formalina se incluye en parafina y se cortan esas secciones con instrumentos con cuchillas de microtomo para obtener muestras en portaobjetos y observarlas con tinciones específicas e inmunohistoquímica. Si bien la mayoría de las muestras fijadas en formalina no son infecciosas, M. tuberculosis y el agente de CJD pueden persistir en forma transmisible en material fijado en formalina e incluido en parafina. La exposición a formaldehído tóxico es habitual.
- En citología reciben grandes y pequeños volúmenes de fluidos corporales, muestras de médula ósea o muestras de aspiración con aguja; la mayoría de estas muestras se reciben fijadas, pero otras deben ser procesadas obteniendo alícuotas o vertiendo grandes volúmenes de fluidos corporales, lo cual puede producir salpicaduras y derrames. Los procedimientos como centrifugación y procesamiento con Cytospin pueden producir aerosoles. Los portaobjetos secados al aire pueden ser una fuente de contaminación hasta que se los fija y se aplica una tinción.
5.9.1. Recepción de muestras y registro
- Manipule las muestras con las precauciones estándares y use guantes para recibir y registrar muestras (2,57). Las áreas de recepción de todos los laboratorios de patología quirúrgica se consideran áreas sucias y todos los recipientes exteriores se consideran contaminados.
- Envíe las muestras, incluidas las biopsias de piel y gastrointestinales, entregadas por la sala de operaciones, de autopsia o de sitios de recolección externos en recipientes a prueba de fugas, o colóquelas en recipientes fijadores de muestras en el sitio de recolección. Coloque la muestra en una segunda bolsa o recipiente a prueba de fugas y rotúlela como peligro biológico. Coloque la solicitud en un bolsillo externo donde se evite la contaminación con la muestra.
- Muestras con fugas o visiblemente contaminadas
Las muestras se pueden contaminar con tejidos frescos, sangre o formalina. La manipulación depende de si la muestra está fresca o fijada en formalina.
— Si la muestra se envía en material de fijación y el recipiente secundario no tiene fugas, ajuste el tapón de la muestra y coloque el recipiente primario en una bolsa limpia; limpie cualquier resto de formalina de la superficie de la mesa.
— Si la muestra se envía como tejido fresco y el recipiente exterior presenta fugas, coloque la muestra en otro recipiente y procésela usando el PPE adecuado. Después las muestras se deben transferir a un recipiente limpio y rotularse.
— Si la solicitud está contaminada, deséchela como residuo de peligro biológico y reemplácela.
5.9.2. Trabajo en una mesa abierta
- Separe la sala de registro y las áreas administrativas de la sala de examen macroscópico si se utilizan tejidos frescos o criostatos en la misma área abierta (56,76,77).
- Manipulación de tejidos frescos
— Examine el tejido fresco en un BSC si es posible, o en una sala separada del resto de las estaciones de examen de patología macroscópica quirúrgica. Use una mascarilla N95 y demás PPE similar al usado en una autopsia, según el volumen de sangre y la probabilidad de exposición a fluidos corporales (56). Los tejidos frescos nunca deben manipularse sin guantes. Se recomienda el uso de PPE tal como se usa en una autopsia para la manipulación de tejido fresco (2,56,57,80,81).
— En patología humana, guarde el tejido fresco que no vaya a ser fijado o no pueda ser fijado adecuadamente (p. ej., dientes o cuerpos extraños) en un recipiente doble y sellable a prueba de fugas; rotúlelo como peligro biológico y guárdelo en un refrigerador o congelador (2).
— Las precauciones estándares contra infecciones transmitidas por la sangre se deben utilizar independientemente de la historia clínica (79). - Cortes congelados
— El seccionamiento por congelación se realiza en tejido fresco y es un procedimiento de alto riesgo de exposición a infecciones. La congelación del tejido no mata los organismos y el uso de cuchillas de corte de criostato genera aerosoles potencialmente peligrosos. Analice la verdadera necesidad de realizar un seccionamiento por congelación con el equipo quirúrgico.
— Si bien algunos instrumentos de criostato tienen un drenaje en el instrumento, los aerosoles se dispersan a la sala cuando se produce el corte. No use pulverizadores propulsores de congelación, que acortan el proceso de congelación en unos pocos segundos y producen aerosolización no solo del tejido que se está congelando sino también de los tejidos de muestras cortadas anteriormente que están en la base del instrumento. Dichos procedimientos generan contaminación por aerosoles y gotas y conllevan un riesgo infeccioso para todo el personal del área (56,79,82). El Instituto de Estándares Clínicos y de Laboratorio y otros han recomendado discontinuar los pulverizadores para congelación ya que los fabricantes de instrumentación de criostatos no los recomiendan (2,79).
— Lo ideal es usar criostatos en una sala cerrada con ventilación del aire directamente al exterior o con recirculación del aire a través de un filtro HEPA para evitar la contaminación del resto de la sala de patología quirúrgica.
— Ciertos criostatos tienen luces ultravioletas, pero estas no sustituyen la limpieza terminal del instrumento y no han sido eficaces para matar micobacterias.
— En laboratorios de patología humana, deben usarse guantes, protector facial o gafas y una mascarilla N95 durante el procesamiento. - Corte de huesos. Consulte la Sección Autopsia 5.2.2.
- Tejido fijado
— Fije el tejido en formalina al 10 % en una concentración que sea 10 veces el volumen del tejido, a fin de garantizar una fijación eficaz y de reducir el potencial de contaminación infecciosa. No obstante, la viabilidad de los organismos infecciosos depende de diversas variables que no se han identificado con claridad, y se ha demostrado que el tejido fijado sigue siendo infeccioso (78). M. tuberculosis se ha transmitido de muestras fijadas y se ha cultivado en muestras fijadas, y CJD no es inhibida por la concentración de rutina de formalina. Las estaciones de examen macroscópico en las que se cortan muestras fijadas en formalina están diseñadas para disminuir los gases del formaldehído, pero no son BSC (2,57,83–85). Las muestras fijadas en formalina se deben manipular con guantes.
— Use las precauciones estándares y PPE apropiado en todas las tareas con tejido fijado. Los protectores faciales son óptimos para la protección completa de la cara y el cuello si es probable que se produzca una salpicadura de formalina. Los protectores son el objeto más cómodo para usar durante períodos extensos a la vez que le permiten al usuario usar gafas recetadas o realizar un dictado.
— Las gafas de lectura y lentes de contacto no sustituyen la protección ocular.
— Las gafas de seguridad y mascarilla resistente a líquidos son una opción alternativa pero no la preferida.
— Use protectores faciales/gafas que se puedan descontaminar o sean desechables.
— Mantenga cerrados los recipientes que contienen tejidos en formalina a fin de reducir los gases de exposición. - Muestras para citología
— El PPE depende de la muestra. Se debe usar guantes y bata de laboratorio con todas las muestras hasta que los portaobjetos estén fijados y con tinción.
— Vierta o separe en alícuotas las muestras de gran volumen con potencial de salpicaduras y/o aerosolización dentro de un BSC, y use indumentaria resistente a líquidos, delantal y dos pares de guantes.
— Abra en un BSC los fluidos corporales de poco volumen o los aspirados enviados en tubos o use un protector contra salpicaduras o un protector facial y separe las alícuotas con una pipeta desechable en lugar de verterlos para evitar salpicaduras y derrames.
— Manipule las muestras recibidas en material de fijación con guantes debido a la toxicidad del material de fijación y a la posible contaminación externa (57). Si en la preparación del portaobjetos se usará una preparación con Cytospin, el sistema debe incluir un tazón con tapa de seguridad y cubierta externa.
— Considere todos los portaobjetos, frotis de impresión, preparaciones citológicas y frotis de médula ósea como infecciosos hasta que estén fijados y con tinción.
Use una centrífuga de seguridad con pocillos de seguridad con arandelas y tapas sellables para la centrifugación de fluidos (51). - Descontaminación
— Criostato. Las virutas del instrumento generadas al cortar se consideran contaminadas. Junte los cortes acumulados y deséchelos como residuos de peligro biológico. Descongele el instrumento y descontamínelo diariamente con alcohol al 70 %. Descontamínelo semanalmente con un desinfectante contra la tuberculosis o después de un caso de infección por M. tuberculosis conocido. Use guantes de malla de acero inoxidable mientras limpia las cuchillas del microtomo.
— Microtomo. Considere un cronograma similar al que se utiliza con los criostatos.
— Considere todas las superficies, computadora, teléfono y encimeras como contaminados si alguna persona con guantes tocó esos objetos. Desinfecte el equipo y las superficies de las mesas diariamente.
— Quítese los guantes y lávese las manos con agua y jabón antes de salir de las distintas salas del laboratorio.
5.9.3. Áreas limpias en comparación con áreas sucias del laboratorio
Todas las áreas de especialización en patología quirúrgica (salas de citología, histología, examen macroscópico o seccionamiento por congelación) se consideran áreas sucias si se reciben o procesan muestras frescas o fluidos corporales en una sala abierta (no en un BSC o un área con ventilación independiente).
5.9.4. Tinciones de tejidos
En histología y citología se realizan múltiples procedimientos de tinción. Aquí se incluyen los más frecuentes. Algunas de esas tinciones se preparan con etanol y algunas con metanol, lo cual puede afectar las opciones de gestión para su desecho. Proporcione las hojas de datos de seguridad de materiales (MSDS) de cada componente en el laboratorio.
- Tinción con hematoxilina
La tinción con hematoxilina no es peligrosa según las reglamentaciones de la Agencia de Protección Ambiental. Se recomienda su desecho en el desagüe con el permiso de las autoridades locales de tratamiento de aguas residuales. Cumpla las reglamentaciones federales, estatales y locales. - Tinción de Giemsa
El método preferido para desechar la tinción de Giemsa es la incineración en una planta autorizada de tratamiento de residuos peligrosos. Las localidades pueden restringir las cantidades de alcoholes que se pueden arrojar al desagüe; consulte a las autoridades correspondientes. Asegúrese de cumplir con todas las reglamentaciones gubernamentales locales, estatales y federales. - Tinción de Wright
La tinción de Wright contiene metanol, un residuo clasificado como peligroso. No es aceptable ni está permitido desechar en alcantarillas residuos clasificados como peligrosos. El método de eliminación preferido es la incineración. Asegúrese de cumplir con todas las reglamentaciones gubernamentales.
5.9.5. Fijadores
- Formalina (HCHO)
— El formaldehído se puede adquirir en forma de solución de HCHO al 37 % - 40 %. La preparación más habitual de formaldehído es formalina al 10 % (formaldehído al 3,7 % - 4 %), que está disponible comercialmente. No se recomienda diluir formalina ni formaldehído, a fin de limitar la exposición. Los gobiernos locales suelen restringir las cantidades de aldehídos que se pueden desechar por el desagüe. Cada laboratorio debe cumplir con todas las reglamentaciones gubernamentales.
— La neutralización es el método preferido para desechar el formaldehído. Los reactivos neutralizantes aportan un método práctico y eficaz en función de los costos de desechar soluciones de formaldehído, glutaraldehído y otras soluciones de aldehídos. Estos convierten a los aldehídos peligrosos en agua y polímeros no peligrosos, no corrosivos y no tóxicos. El polímero producido no es un residuo peligroso, según la definición del Título 40 del Código de Reglamentaciones Federales de los EE. UU. (71). Esos agentes neutralizantes tienden a reducir los costos de la eliminación de residuos y contribuyen a que el ambiente de trabajo sea más seguro. En algunos casos, después del tratamiento de residuos de formaldehído con productos de cristal, el residuo sólido resultante puede desecharse mediante los flujos aprobados para residuos sólidos de laboratorio. Antes de desechar soluciones de formalina neutralizada por el desagüe, asegúrese de contar con la aprobación formal de las autoridades locales correspondientes encargadas de aguas residuales.
— Use guantes protectores y ropa protectora adecuados para evitar la exposición de la piel. Use gafas protectoras, gafas de seguridad para sustancias químicas o protectores faciales completos, como se describe en las reglamentaciones de protección ocular y facial de la OSHA en 29 CFR 1910.133 (72) o la Norma europea EN166. No use lentes de contacto mientras trabaja con formalina. Mantenga estaciones para lavado de ojos y regaderas en el área de trabajo. - Otros fijadores para patología
— Los fijadores se clasifican como residuos regulados. El estándar de la OSHA Patógenos transmitidos por la sangre, 29 CFR Parte 1910, 1048 y 1030 exige que las muestras para patología se coloquen en recipientes secundarios diseñados para soportar todo el contenido y evitar la fuga de líquidos durante la manipulación, almacenamiento, transporte y envío (33,70).
— Rotule los recipientes secundarios como peligro biológico y cierre el recipiente herméticamente antes de retirarlo para evitar el derrame del contenido durante la manipulación, el almacenamiento, el transporte y el envío. - Xilenos y alcoholes
— El xileno está clasificado por la EPA como un residuo peligroso según la Ley de conservación y recuperación de recursos (Resource Conservation and Recovery Act, RCRA), y la EPA le ha asignado el número de residuo peligroso U239. Los residuos de xileno pueden separarse de la parafina disuelta mediante destilación, y las unidades de reciclaje disponibles comercialmente pueden lograr esa separación de forma eficaz a fin de producir xileno reutilizable. El xileno también puede desecharse a través de un contratista debidamente autorizado especializado en residuos peligrosos si el xileno se encuentra en un envase orgánico metálico o un envase orgánico de laboratorio que cumpla los requisitos de 40 CFR 264.316 o 265.316 (71).
— El xileno que no puede guardarse para recuperación ni reciclaje debe manipularse como residuo peligroso y enviarse a un incinerador aprobado por la RCRA o ser desechado en una planta de tratamiento de residuos aprobada por la RCRA. El procesamiento, el uso o la contaminación de este producto pueden cambiar las opciones de gestión de los residuos. Las reglamentaciones estatales y locales para el desecho pueden ser distintas de las reglamentaciones federales para el desecho. Elimine el recipiente y el contenido no usado de acuerdo con los requisitos federales, estatales y locales.
— Las pautas para el desecho de alcoholes (alcohol etílico, alcohol isopropílico, alcohol metílico) son idénticas a las del xileno. - Análisis para detectar exposición a formalina y xileno
Realice análisis periódicos con placas de sustancias químicas para un periodo de 8 horas y al menos un periodo de 15 minutos regularmente, para evaluar la exposición a formaldehído de las personas que están expuestas rutinariamente (p. ej., tecnólogos, encargados de examen macroscópico de tejidos, patólogos residentes) y rote entre diversas áreas a fin de evaluar todas las estaciones de trabajo.
5.10. Controles de ingeniería y renovaciones de las instalaciones
Al actualizar o renovar las áreas de autopsia y otras salas del laboratorio de anatomía patológica que procesan tejidos frescos y fluidos corporales, se debe tener en cuenta lo siguiente.
- Diseñar áreas cerradas para la recepción de muestras/administrativas si no hay BSC para procesar muestras frescas o si los criostatos están en la misma área que el personal administrativo.
- Contar con salas con flujo de aire negativo en relación con las salas vecinas.
- Instalar un BSC para procesar muestras frescas.
- Contar con una sala aparte para los criostatos y mantener las sierras para hueso separadas del resto de las sala de examen macroscópico quirúrgico.
5.11. Enfermedad de Creutzfeldt-Jakob
Se requieren precauciones especiales para la autopsia y la descontaminación de la sala de autopsia, corte de cerebro y procedimientos de preparación de tejido histológico al procesar casos de posible CJD (1,56,65,67,86).
5.11.1. Autopsia
Realice autopsias utilizando precauciones BSL-2 reforzadas por la ventilación y las precauciones respiratorias de las instalaciones BSL-3. Use PPE estándar para autopsia. Limite la autopsia a la extracción del cerebro. Restrinja la cantidad de participantes exclusivamente a los que sean necesarios. Guarde el cerebro en una bolsa doble y colóquelo en un recipiente de plástico para congelarlo o fijarlo en formaldehído al 3,7 % - 4 % después de seccionarlo. La fijación con formaldehído ocurre entre 10 y 14 días antes de la recolección de los cortes histológicos.
5.11.2. Preparaciones histológicas
- Los priones siguen siendo transmisibles después de la fijación con formalina y la inclusión en parafina. (56,64,66,86).
- El PPE incluye guantes, bata de laboratorio, delantal y protección facial.
- Antes de la preparación de los portaobjetos para histología, se sumergen pequeños bloques de tejido cerebral de < 5 mm de grosor en ácido fórmico al 95 % - 100 % durante 1 hora, seguido de sumersión en formaldehído fresco al 4 % durante al menos 48 horas. Dicho tejido se puede procesar manualmente o con una máquina. Luego, los bloques y portaobjetos se pueden manipular como se hace rutinariamente. Si en el laboratorio se prefiere el procesamiento manual, los procedimientos son los mismos que para los tejidos no tratados.
- Si el tejido no fue pretratado con ácido fórmico antes de incluirlo, se deben usar guantes dobles y protección ocular en todo momento, incluido el momento del seccionamiento. Todas las soluciones, incluidos los cambios de agua, se juntan y se tratan con volúmenes iguales de lejía recién preparada sin diluir o NaOH 1N durante 60 minutos. Los suministros desechables se incineran o se esterilizan en el autoclave a la temperatura y presión adecuadas (1,56,86). Los objetos de vidrio y herramientas generalmente se sumergen en lejía sin diluir durante 1 hora y luego se enjuagan bien. Si es adecuado para la herramienta, se puede esterilizar en el autoclave a la temperatura y presión apropiadas. El equipo que no se puede sumergir ni pasar por el autoclave se debe limpiar con lejía sin diluir y se debe dejar reposar durante 30 minutos.
- Se debe tomar la precaución de recoger todos los restos de parafina y cortes no utilizados sobre una hoja de papel desechable. El microtomo puede limpiarse con una solución de lejía o hidróxido de sodio, pero no se lo puede descontaminar exhaustivamente. Si se atienden casos frecuentes de posibles casos de CJD, a los laboratorios tal vez les convenga utilizar un microtomo viejo para ese fin.
- Todos los residuos deben recolectarse y desecharse. Deseche la cuchilla con los objetos cortopunzantes.
- En los portaobjetos no tratados, la tinción de tejidos se aplica a mano en pocillos desechables para muestras o placas de Petri. Los portaobjetos se rotulan como CJD infecciosa y se guardar/archivan en un recipiente con un rótulo adecuado. El bloque seccionado se sella con parafina.
- Los restos de tejidos se desechan como residuos hospitalarios infecciosos para incineración. Los líquidos se diluyen 1:1 en lejía sin diluir durante 1 hora antes de desecharlos.
- Es posible que se requiera equipo exclusivo para este fin según las jurisdicciones locales.
6. Laboratorio de parasitología
La exposición a parásitos infecciosos durante procedimientos de diagnóstico puede producirse por manipular muestras, extraer sangre, realizar diversos tipos de procedimientos de concentración, cultivar organismos y realizar estudios de inoculación en animales. Los parásitos relevantes y sus posibles vías de infección se enumeran en la Tabla 7 y el Recuadro 1. La Tabla 8 contiene información sobre la resistencia a antisépticos y desinfectantes.
6.1. Recepción de muestras y estación de registro/preparación
- Las muestras frescas (heces, otras muestras del aparato digestivo, orina, sangre, tejidos, líquido cefalorraquídeo, otros fluidos corporales, artrópodos) representan una posible fuente de parásitos infecciosos.
- Las precauciones de seguridad incluyen la correcta rotulación de los fijadores; designar áreas específicas para la manipulación de muestras (es posible que se necesiten gabinetes de seguridad biológica en ciertas circunstancias); recipientes apropiados para centrifugación; políticas de desecho aceptables; políticas apropiadas que prohíban comer, beber y fumar en las áreas de trabajo y, si corresponde, técnicas correctas para el cultivo de organismos y/o la inoculación de animales.
- Recolecte o transfiera todas las muestras a un recipiente primario a prueba de fugas con una tapa segura (evite las tapas de fácil apertura).
- Use balsas de plástico desechables con bolsillos separados para el talón de solicitud y la muestra cuando sea posible (2,87).
6.1.1. Recipientes con fugas
- Inspeccione visualmente todos los recipientes con muestras para ver si hay fugas.
- Los recipientes primarios contaminados se deben descontaminar antes de seguir manipulándolos. En algunas circunstancias, tal vez sea necesario transferir el contenido a un recipiente limpio u obtener otra muestra antes de enviarla al área de análisis.
- Deseche las solicitudes contaminadas como residuos de peligro biológico y reemplácelas.
6.1.2. Tapas flojas
- Las muestras de sangre se envían en tubos, por lo general, tubos Vacutainer (con tapones de color lavanda o verde). Si el tapón parece flojo o hay evidencia de sangre en el exterior del tubo, empuje el tapón dentro del tubo para asegurarlo y solicite a la persona que lo envió que presente otra muestra. Si no se puede repetir la obtención de la muestra, descontamine el exterior antes de procesar la muestra.
6.2. Tinciones y reactivos (88,89)
6.2.1. Tinción tricrómica
- La modificación de Wheatley de la tinción tricrómica de tejidos de Gomori no se considera un residuo peligroso pero debe desecharse de acuerdo con las reglamentaciones de control ambiental federales, estatales y locales.
- Se recomienda su desecho en el desagüe con el permiso de las autoridades locales de tratamiento de aguas residuales.
6.2.2. Tinción con hematoxilina
- La tinción con hematoxilina no es peligrosa según las reglamentaciones de la Agencia de Protección Ambiental (EPA).
- Se recomienda su desecho en el desagüe con el permiso de las autoridades locales de tratamiento de aguas residuales. Las reglamentaciones canadienses para desechos suelen ser paralelas a las de los Estados Unidos.
- Cumpla las reglamentaciones federales, estatales y locales.
6.2.3. Yodo
- Deseche todo el líquido y material relacionado con parasitología contaminado con yodo en recipientes para residuos aprobados por el Departamento de Transporte (DOT).
- La incineración de los líquidos es el método de desecho sugerido.
- Cumpla todas las reglamentaciones federales, estatales y locales en materia de desecho.
6.2.4. Tinciones para ácido-alcohol resistencia (modificadas)
- Elimine el recipiente y el contenido no usado de acuerdo con los requisitos federales, estatales y locales aplicables.
- Las reglamentaciones estatales y locales para el desecho pueden ser distintas de las reglamentaciones federales para el desecho.
6.2.5. Tinción de Giemsa
- El método de desecho preferido es la incineración en una planta autorizada de tratamiento de residuos peligrosos.
- Los diferentes lugares pueden restringir las cantidades de alcoholes que se pueden desechar a través del desagüe. Asegúrese de cumplir con todas las reglamentaciones gubernamentales.
6.2.6. Tinción de Wright
- El método de desecho preferido es la incineración en instalaciones autorizadas.
- Los diferentes lugares pueden restringir las cantidades de alcoholes que se pueden desechar a través del desagüe. Asegúrese de cumplir con todas las reglamentaciones gubernamentales aplicables.
6.2.7. Formalina (HCHO)
- El formaldehído normalmente se adquiere como una solución de HCHO al 37 % - 40 %; no obstante, para dilución se debe considerar como al 100 %. Normalmente, se utilizan dos concentraciones: 5 %, que se recomienda para la conservación de quistes protozoarios, y 10 %, que se recomienda para huevos y larvas de helmintos. Si bien suele recomendarse 5 % para cualquier uso, la mayoría de los fabricantes comerciales lo proporciona al 10 %, que tiene mayores probabilidades de matar todos los huevos de helmintos. La preparación más habitual de la formalina es formalina al 10 %.
- La incineración es el método preferido para desechar el formaldehído.
- Los gobiernos locales suelen restringir las cantidades de aldehídos que se pueden desechar por el desagüe. Cada laboratorio deberá cumplir con todas las reglamentaciones gubernamentales.
- Use reactivos neutralizantes para desechar formaldehído peligroso. Deben emplearse compuestos comerciales y soluciones de aldehídos seguras. Estos convierten el glutaraldehído y otros aldehídos más peligrosos en agua y polímeros no peligrosos, no corrosivos y no tóxicos. El polímero producido no es un residuo peligroso, según la definición del Título 40 del CFR 261.24(a) de los EE. UU. (71). Esos agentes neutralizantes tienden a reducir los costos de la eliminación de residuos y contribuyen a que el ambiente de trabajo sea más seguro.
- En algunos casos, después del tratamiento de residuos de formaldehído con productos de cristal, el residuo sólido resultante puede desecharse mediante los flujos aprobados para residuos sólidos de laboratorio. Antes de desechar soluciones de formalina neutralizada por el desagüe, obtenga la aprobación formal de las autoridades locales encargadas del tratamiento de aguas residuales.
- Use guantes protectores y ropa protectora para evitar la exposición de la piel. Si no se está usando un gabinete de seguridad biológica (BSC) al retirar muestras de viales que contienen formalina, use gafas protectoras o gafas de seguridad para sustancias químicas y protectores faciales, como se describe en las reglamentaciones sobre protección ocular y facial de la Administración de Seguridad y Salud Ocupacional (OSHA) en 29 CFR 1910.133 (72) o la Norma europea EN166.
- Mantenga una estación de lavado de ojos y regaderas según la especificación del Instituto Estadounidense de Estándares Nacionales (ANSI) en el área de trabajo.
6.2.8. Fijadores a base de mercurio
- El uso de mercurio en el análisis químico puede ser abandonado gradualmente en la mayoría de los laboratorios de parasitología, si no es que en todos ellos. Ahora existen excelentes productos comerciales seguros que pueden reemplazar los fijadores, como solución de Zenker, fijadores para histología y otros productos que antes requerían el uso de mercurio. Algunos sustitutos, como los compuestos de cobre, estaño, zinc y cromo también implican cierto riesgo, pero es menor que el asociado con el mercurio.
- Las compañías de reciclaje pueden aceptar o no los residuos que contienen mercurio, incluidas las soluciones de laboratorio. Las compañías difieren en cuanto al tipo de residuos de mercurio aceptados y los requisitos de transporte (90–98).
6.2.9. Fijadores a base de zinc (que contienen formalina)
- En general, la EPA no considera peligrosos los fijadores a base de zinc (en virtud de la Ley de conservación y recuperación de recursos [RCRA]) y ahora se los acepta como buenos sustitutos para los fijadores que contienen compuestos a base de mercurio. Estos sustitutos del mercurio no deben desecharse con los residuos sólidos a menos que hayan sido neutralizados con uno de los productos de destoxificación disponibles comercialmente (71,99).
- Deseche los materiales de acuerdo con los requisitos federales (40 CFR 261) (71), estatales y locales.
- El agente de limpieza recomendado es agua.
- La formalina de zinc es tóxica debido a su contenido de formaldehído. Deséchela mediante un transportista de residuos autorizado. No mezcle los flujos de agua a menos que su transportista de residuos le indique que lo haga. Algunas autoridades responsables del tratamiento de aguas residuales pueden otorgar permiso para desechar por el desagüe cantidades limitadas si el contenido de zinc es < 600 ppm.
- La formalina de zinc es reciclable y se puede neutralizar con productos destoxificantes disponibles comercialmente.
- Ahora existen fijadores a base de zinc que no contienen formalina. Los fijadores universales como Total-Fix no contienen mercurio, alcohol polivinílico ni formalina y pueden usarse para concentración, frotis con tinción permanente e inmunoensayos fecales, excepto por Entamoeba histolytica y el grupo Entamoeba histolytica/E. dispar, que requieren muestras frescas o congeladas para el análisis. Los análisis de especies de Giardia y Cryptosporidium pueden hacerse con muestras frescas y también con muestras preservadas. Deseche los materiales de acuerdo con los requisitos federales (40 CFR 261) (71), estatales y locales.
6.2.10. Fijadores a base de cobre (que no contienen formalina)
- Muchas localidades restringen las cantidades de compuestos de cobre que pueden desecharse por el desagüe.
- Asegúrese de cumplir con todas las reglamentaciones gubernamentales.
6.2.11. Xileno y alcoholes
- El xileno está clasificado como un residuo peligroso según la RCRA, y la EPA le ha asignado el número de residuo peligroso U239. El uso de uno de los actuales sustitutos comerciales del xileno evitará la necesidad de encarar la manipulación especial requerida para el manejo de residuos peligrosos que se describe aquí.
- El xileno puede desecharse en un envase organometálico o un envase orgánico de laboratorio que cumpla los requisitos de 40 CFR 264.316 o 265.316 (71). El xileno puede destilarse usando diversas unidades de reciclaje disponibles comercialmente para producir xileno reutilizable.
- El xileno que no puede guardarse para recuperación ni reciclaje debe manipularse como residuo peligroso y enviarse a un incinerador aprobado por la RCRA o ser desechado en una planta de residuos aprobada por la RCRA.
- El procesamiento, el uso o la contaminación de este producto pueden cambiar las opciones de gestión de los residuos. Las reglamentaciones estatales y locales para el desecho pueden ser distintas de las reglamentaciones federales para el desecho. Elimine el recipiente y el contenido no usado de acuerdo con los requisitos federales, estatales y locales.
- Las pautas para el desecho de alcoholes (alcohol etílico, alcohol isopropílico, alcohol metílico) son idénticas a las del xileno.
6.3. El trabajo en la mesa
- En general, se aplican las mismas precauciones y prácticas que se usan en los laboratorios de microbiología en los procedimientos de diagnóstico de parasitología, en especial en lo que respecta a la transmisión de aerosoles (2,33).
- Las pautas para la recolección y procesamiento de muestras incluyen precauciones estándares además del uso de equipo recomendado según los métodos aprobados (p. ej., BSC, campanas de extracción de gases, centrífugas, objetos cortopunzantes, objetos de vidrio) (2,100,101).
6.4. Precauciones personales
6.4.1. Gabinete de seguridad biológica en comparación con campana de extracción de gases
- Si bien el uso de una campana de extracción de gases no es obligatorio para procesar muestras de materia fecal que contienen formalina, use un programa de vigilancia de formalina que cumpla con la OSHA.
- Incluso si se reemplazan reactivos deshidratantes que no sean xileno, se recomienda el uso de campanas de extracción de gases para eliminar los olores de la materia fecal y los solventes. Un modelo pequeño de mesa es aceptable.
- No es obligatorio el uso de un BSC para procesar muestras fecales en el laboratorio de parasitología; no obstante, algunos laboratorios usan un BSC clase I (de frente abierto), o en muchos casos, clase II-A2 (con flujo laminar) para procesar todas las muestras no preservadas.
- Se recomienda el uso de un BSC, en especial si en el laboratorio se procesan muestras frescas o se realizan cultivos para aislamiento de parásitos (Tabla 7).
6.4.2. Equipo de protección personal
- Utilice una higiene adecuada de las manos (lavado y antisépticos) para el trabajo de laboratorio en un laboratorio de diagnóstico de parasitología.
- Use guantes desechables de látex, vinilo o nitrilo durante el registro y procesamiento de todas las muestras para examen parasitológico, en especial al manipular muestras de sangre, fluidos corporales o materia fecal (100,101); esta recomendación es aplicable independientemente de que las muestras sean frescas o se envíen en conservantes para materia fecal. Lávese siempre las manos después de quitarse los guantes.
6.4.3. Vacunación
- El Comité Asesor sobre Prácticas de Inmunización (Advisory Committee on Immunization Practices) recomienda que todas las personas cuyas actividades laborales impliquen la exposición a sangre u otros fluidos corporales potencialmente infecciosos en el ámbito de la atención de la salud o en un laboratorio reciban la vacuna contra la hepatitis B. No se recomiendan dosis de refuerzo (102).
- Debe conservarse documentación que incluya declaraciones firmadas y registros de la vacunación contra la hepatitis B o de su rechazo.
6.4.4. Desinfección
Las recomendaciones generales formuladas para el laboratorio de microbiología son suficientes para la sección de diagnóstico de parasitología; estas incluirían pautas para la desinfección de superficies de mesas, teléfonos, computadoras, equipo y teléfonos de manos libres.
6.5. Áreas sucias en comparación con áreas limpias del laboratorio
Las pautas generales para el laboratorio de microbiología también se aplican a la sección de parasitología del laboratorio. No se necesitan recomendaciones especiales.
6.6. Instrumentación
Los requisitos de seguridad para el uso de instrumentos son los mismos que los usados para un laboratorio general de microbiología y se relacionan, principalmente, con la manipulación de las muestras.
6.7. Análisis parasitológico de anticuerpos y antígenos
Los requisitos de seguridad para el análisis de anticuerpos y antígenos son los mismos que los utilizados en un laboratorio general de microbiología o inmunología y se relacionan, principalmente, con la manipulación de muestras.
7. Laboratorio de micología
Si bien no es un requisito estricto, se recomienda que los laboratorios de micología que cultivan hongos filamentosos y manipulan esos organismos estén separados y aislados del laboratorio principal de microbiología, con presión de aire negativa que vaya hacia la sala desde el laboratorio principal. El acceso directo a un gabinete de seguridad biológica (BSC) clase II es fundamental para esta actividad, ya sea que el trabajo de micología se realice en una sala aparte o en una sección aislada del laboratorio principal. La mayoría del trabajo de diagnóstico de micología puede realizarse en un laboratorio con un nivel de bioseguridad (BSL)-2.
7.1. Recepción de muestras y estación de registro/preparación
7.1.1. Recipientes con fugas
Las pautas para el laboratorio general de microbiología también se aplican al laboratorio de micología. No se necesitan recomendaciones especiales.
7.1.2. Contaminación visible en el exterior del recipiente
Las pautas para el laboratorio general de microbiología también se aplican al laboratorio de micología. No se necesitan recomendaciones especiales.
7.1.3. Tapas flojas
Las pautas para el laboratorio general de microbiología también se aplican al laboratorio de micología. No se necesitan recomendaciones especiales.
7,2. Manchas y desecho
7.2.1. Tinción de Gram
La tinción de Gram no es la tinción óptima para hongos pero si se la usa, en especial con levaduras, las mismas pautas que se aplican a la bacteriología/microbiología clínica se siguen en micología.
7.2.2. Tinciones para micología
- El blanco de calcoflúor no se considera una sustancia peligrosa; no se requieren medidas especiales de seguridad. Use procedimientos de laboratorio de rutina: es decir, después del contacto con la piel, lave el área con agua y jabón; después del contacto con los ojos, enjuáguelos bien con agua; procure atención médica si se informa una enfermedad después de la inhalación o la ingestión.
- Siga los procedimientos aceptados de laboratorio aplicados a los materiales infecciosos para la manipulación y desecho de los portaobjetos. Las células de hongos teñidas con blanco de calcoflúor pueden seguir siendo viables.
- Si se emplea hidróxido de potasio (KOH) con el blanco de calcoflúor, deben tomarse precauciones más estrictas. Para orientación, consulte la hoja de datos de seguridad de materiales (103).
— Una solución de KOH al 10 % - 15 % es corrosiva. Manipúlela con cuidado. El KOH puede provocar quemaduras o irritación en la piel, los ojos y las vías respiratorias. Evite el contacto con los ojos/la piel, y la inhalación o ingestión. Use guantes y protección ocular si hay peligro de salpicaduras o de formación de aerosoles.
— El KOH no está clasificado como un residuo peligroso según la Ley de conservación y recuperación de los recursos (RCRA). La pequeña cantidad usada en un portaobjetos con blanco de calcoflúor puede desecharse con los portaobjetos que contienen materiales infecciosos. Si se deben desechar cantidades mayores, hágalo de acuerdo con los requisitos federales, estatales y locales (104–106). - Azul de algodón en lactofenol (azul anilina en lactofenol o azul de Poirrier)
— En las cantidades que se utilizan habitualmente en un laboratorio clínico, el azul de algodón en lactofenol es ácido; evite el contacto con la piel, los ojos y la ropa.
— Enjuague minuciosamente con agua si hay un derrame.
— Con portaobjetos de hongos teñidos con el líquido, siga los procedimientos aceptados de laboratorio para manipular y desechar los materiales infecciosos.
— Si deben desecharse o producirse mayores cantidades, el producto se considera más peligroso, es decir, tóxico por inhalación y contacto con la piel y, en especial, si se ingiere. Utilice el producto solo con la ventilación adecuada.
— Deséchelo como residuo peligroso de acuerdo con las reglamentaciones federales, estatales y locales (107–109). - Tinta china
— No se requiere protección personal especial en las condiciones de uso normales; no obstante, las células de levaduras pueden seguir siendo viables.
— La tinta china no es un residuo peligroso regulado. Deséchela de acuerdo con las reglamentaciones federales, estatales y locales aplicables y deseche los portaobjetos de forma segura (110). - Tinción para ácido-alcohol resistencia
Las pautas para el laboratorio de tuberculosis también se aplican al laboratorio de micología. No se necesitan recomendaciones especiales. - Tinción con metenamina de plata de Gomori
— Los ingredientes son tóxicos, corrosivos y perjudiciales; evite el contacto con la piel y los ojos.
— Utilice el producto con la ventilación adecuada; no lo inhale.
— Deséchelo como residuo peligroso de acuerdo con las reglamentaciones federales, estatales y locales aplicables (111). - Tinción de Giemsa
— Debido a su contenido de metanol, la tinción de Giemsa es tóxica por inhalación, absorción o ingestión. El uso de guantes protectores y gafas de seguridad no es obligatorio pero está recomendado.
— Deséchela de acuerdo con las reglamentaciones federales, estatales y locales. El método preferido es la incineración en instalaciones autorizadas (112).
7.3. Lectura de cultivos en la mesa (1,113)
- Se recomienda contar con una sala cerrada aparte para las actividades de micología, pero no es obligatorio.
- Realice todas las manipulaciones de cultivo en un BSC ya sea que esté en otra sala o dentro de un espacio designado en el laboratorio abierto de microbiología. Todas las colonias de mohos (filamentosos, vellosos, algodonosos) deben manipularse en un BSC clase II. Eso se aplica también a los mohos que crecen en placas bacteriológicas. Consulte información adicional en la Sección 7.6.
- Use cierres retráctiles o cinta adhesiva para sellar las cajas de Petri (en especial si el moho comienza a crecer) para evitar la apertura accidental y la diseminación de segmentos de hifas, conidios o esporas.
- Nunca use cajas de Petri si se sospecha la presencia de Coccidioides immitis o si se debe enviar un cultivo filamentoso por correo o se debe transportar de algún otro modo a otro laboratorio. Use cultivos en tubos inclinados en tubos con tapa a rosca.
— Observe todas las placas y tubos inclinados para ver si hubo crecimiento antes de abrirlos. - En general, los cultivos con colonias similares a las de las levaduras se pueden leer en la mesa abierta en un laboratorio BSL-2; pero si se sospecha que el aislado es Cryptococcus neoformans (colonias húmedas y mucoides) o un hongo dimórfico, se deben mover a un BSC clase IIA2.
- Nunca se debe oler un cultivo micótico para determinar si tiene olor. No abra placas con mohos en la mesa abierta, aunque se trate de una estación de trabajo de bacteriología.
7.4. Precauciones personales
7.4.1. Gabinete de bioseguridad
- Se recomienda el BSC clase IIA2 para algunos trabajos de micología, esto es, todos los mohos (vellosos, lanosos, algodonosos, polvosos o aterciopelados) deben manipularse en un BSC y nunca en la mesa abierta.
- En micología, siga las mismas pautas relativas al BSC que se aplican en bacteriología.
7.4.2. Equipo de protección personal
- Las pautas para el laboratorio general de microbiología también se aplican al laboratorio de micología.
- Use guantes y quítese relojes y brazaletes al manipular un cultivo de moho que tenga la posibilidad de ser un dermatófito. Después de completar esa tarea, lávese bien las manos y las muñecas.
7.4.3. Desinfección
Las recomendaciones para el laboratorio general de microbiología son suficientes para los usos en el laboratorio de micología; estas incluyen pautas para la desinfección de superficies de mesas y objetos como teléfonos, computadoras, equipo y teléfonos manos libres.
7.4.4. Descontaminación y desecho de residuos de laboratorio
- Siga las mismas pautas que se aplican a la microbiología clínica.
- Si no se dispone de un autoclave y los residuos médicos se procesan fuera de las instalaciones, abra las placas y los tubos que contengan especies de Coccidioides y déjelos sumergidos por completo en una solución 1:10 de lejía durante toda la noche antes de desecharlos.
7.5. Áreas limpias en comparación con áreas sucias del laboratorio
Las pautas para el laboratorio general de microbiología también se aplican al laboratorio de micología.
7.6. Agentes seleccionados y mohos patogénicos
- Manipule todas las colonias similares a mohos en un BSC.
- Haga una preparación húmeda de todos los mohos cultivados antes de preparar un cultivo en un portaobjetos, a fin de detectar estructuras que puedan indicar la posibilidad de que el aislado sea un hongo sistémico muy patogénico (113).
- No prepare cultivos en portaobjetos de aislados que en la preparación húmeda sugieran la presencia de Histoplasma capsulatum, Blastomyces dermatitidis, Coccidioides immitis, C. posadasii, Paracoccidioides brasiliensis, Penicillium marneffei o Cladophialophora bantiana. Haga todo lo posible por identificarlos mediante preparaciones húmedas bien preparadas y sondas de ADN, si están disponibles (113).
- Si un organismo aislado en el laboratorio se identifica como H. capsulatum, B. dermatitidis, especies de Coccidioides o Paracoccidioides brasiliensis, se recomiendan prácticas e instalaciones BSL-3 para manipular cultivos con forma de mohos y muestras ambientales que probablemente contengan conidios infecciosos (1).
- Las especies de Coccidioides son los únicos hongos que actualmente están clasificados como agente seleccionado que se debe registrar en los CDC/el Departamento de Agricultura de EE. UU. para su posesión, uso, almacenamiento y/o transporte (1,114). Esto podría cambiar en el futuro.
- Para descontaminar aislados de Coccidioides cuando no se cuenta con un autoclave (es decir, cuando una empresa contratada recoge las placas de cultivo para someterlas a autoclave fuera de las instalaciones), deje las placas y los tubos completamente sumergidos durante toda la noche en una solución 1:10 de lejía recién preparada, con los tubos o placas abiertos, antes de desecharlos (consulte la Sección 3.5.3).
7.7. Mesa para hemocultivos
- Las pautas para el laboratorio general de microbiología también se aplican al laboratorio de micología.
- Las placas con crecimiento de colonias similares a mohos deben examinarse en un BSC, no en la mesa abierta.
- Si se detecta una levadura de células pequeñas (~3 µm), considere la posibilidad de que sea H. capsulatum y manipule en condiciones BSL-2 en un BSC clase 2 (113).
7.8. Instrumentación
Los instrumentos usados en estudios de micología son, por lo general, los de vigilancia continua de hemocultivos y para identificación de levaduras. Siga las mismas pautas que se aplican a la bacteriología/microbiología clínica.
7.9. Análisis rápidos (kits)
- Aplique las pautas de microbiología clínica para las levaduras monomórficas analizadas en micología.
- Si el aislado es un moho, se debe manipular en el BSC.
7.10. Análisis molecular
Siga las pautas de seguridad de microbiología clínica para los análisis de micología, con la recomendación adicional de que los aislados de moho se deben manipular en un BSC durante la extracción de ácidos nucleicos.
8. Laboratorio de virología
8.1. Procesamiento de muestras y mesa de registro
8.1.1. Peligros biológicos asociados con la recepción y el registro de muestras
En el laboratorio de virología clínica se recibe una amplia variedad de muestras clínicas para la detección de virus. Dado que la naturaleza infecciosa de ese material se desconoce en gran medida, se debe tener especial cuidado para evitar la contaminación del personal, el ambiente y otras muestras clínicas.
- Manipule todas las muestras clínicas en condiciones con un nivel de bioseguridad (BSL)-2 (1). Algunos patógenos especiales y agentes seleccionados deben manipularse en condiciones de bioseguridad más estrictas.
- Use una bata de laboratorio, guantes y protección ocular siempre que manipule muestras clínicas. Eso incluye los procesos de recepción y registro de muestras.
- Realice la preparación de los cultivos y todas las demás manipulaciones de muestras en un gabinete de seguridad biológica (BSC) clase II o superior.
- Compile una lista de “No procesar/No analizar” que contenga los nombres de agentes sospechosos que no se deben abrir ni procesar (p. ej., viruela, virus Ébola, virus de estomatitis vesicular, virus de la fiebre aftosa, virus de la fiebre porcina, agentes seleccionados de los CDC). Dichas muestras recibidas para análisis deben ser empacadas rápida y adecuadamente y se las debe enviar a un laboratorio de referencia apropiado. Comuníquese con el laboratorio de referencia apropiado antes de hacer un envío.
- Si el laboratorio tiene instalaciones BSL-3, elabore una lista de agentes sospechosos que siempre se deben procesar y analizar en condiciones de BSL-3.
8.1.2. Recipientes con fugas
- No procese recipientes con fugas porque pueden ser un peligro para el tecnólogo, pueden contaminar el laboratorio o pueden ser una oportunidad para que se mezclen especies y/o se produzca contaminación que podría producir un resultado falso.
- Informe al médico tratante o al veterinario u organización que envió la muestra el motivo por el que no se hará el análisis, y solicite una nueva muestra.
- Coloque los recipientes con muestras que presentan fugas en una bolsa de peligro biológico y descontamine en el autoclave o mediante otro método aprobado.
8.1.3. Contaminación visible en el exterior del recipiente
Las muestras con una pequeña cantidad de contaminación (p. ej., una mancha de sangre seca) en el exterior del recipiente se deben informar al director del laboratorio. El director puede examinar la muestra y determinar si es apropiada para análisis y si constituye un peligro para el personal del laboratorio.
8.1.4. Precauciones especiales ante muestras sospechosas
- Acepte muestras transportadas al laboratorio por agentes del orden público de acuerdo con las reglamentaciones locales y estatales y siguiendo los procedimientos de la cadena de custodia. No obstante, el propósito del análisis y el agente sospechoso deben determinarse antes de iniciar el análisis. Asegúrese de que estén implementados los procedimientos adecuados para la cadena de custodia y de que se los respete aunque la muestra no sea procesada.
- El personal de registro y procesamiento de muestras es responsable de marcar la lista de agentes sospechosos “No procesar/No analizar” antes de que la muestra se envíe para análisis (consulte 8.1.1). Notifique al director del laboratorio si el agente sospechoso está en la lista.
- Si el laboratorio tiene instalaciones BSL-3, entregue al personal de procesamiento y registro de muestras una lista de los análisis y agentes sospechosos que solamente se deben manipular en el laboratorio BSL-3.
- No procese ni analice tipos de muestras no aprobadas o inusuales, como se describe en los procedimientos operativos estándares de registro del laboratorio.
- No acepte ninguna muestra que el laboratorio no esté certificado para su análisis.
8.2. Tinciones, sustancias químicas y desecho
- Los peligros químicos del laboratorio de virología y microscopia electrónica variarán según el alcance de los servicios que presta el laboratorio. Los posibles peligros presentados en esta sección son solamente ilustrativos y no incluyen todas las sustancias químicas usadas, además de ser de naturaleza educativa, y no pretenden reemplazar la información de las hojas de datos de seguridad de materiales (MSDS) ni las políticas estatales, locales o institucionales.
- La campana de extracción de gases para productos químicos usada en el laboratorio se debe certificar anualmente y revisarse todos los días para verificar las especificaciones operativas apropiadas.
8.2.1. Alcoholes
En el laboratorio de virología se emplea etanol, metanol, alcohol isopropílico y mezclas de alcoholes para fijar células, para extracción y precipitación de ácidos nucleicos y como desinfectante.
- Guarde los alcoholes concentrados en un gabinete apto para almacenamiento de productos inflamables. Los vapores de alcohol isopropílico y metanol pueden ser tóxicos. Use esos productos únicamente en áreas bien ventiladas. El alcohol isopropílico también puede provocar dermatitis de contacto. Los alcoholes son desinfectantes eficaces para los virus con envoltura pero tienen escaso efecto en los virus sin envoltura.
- No use alcoholes en espacios cerrados. La exposición a gases de solventes puede provocar irritación en ojos, nariz y garganta, mareos, cefalea y sequedad cutánea. Cuando sea posible, utilice esos productos en una campana de extracción de gases.
- No use alcoholes cerca de llamas abiertas o de instrumentos que producen chispas.
- Use guantes de látex, vinilo o nitrilo al manipular alcoholes a fin de minimizar la exposición de la piel.
- Algunos alcoholes empañan los plásticos; se debe tener precaución al limpiar las caras de instrumentos de plástico con alcoholes.
8.2.2. Antibióticos
Los antibióticos de uso de rutina incluyen penicilina, estreptomicina, gentamicina, ciprofloxacina, kanamicina, tetraciclina, anfotericina B y neomicina. Esos antibióticos pueden hallarse en medios de cultivo y medios de transporte viral.
Las mezclas de antibióticos concentrados se usan con frecuencia para aumentar las concentraciones de antibióticos de muestras que contienen grandes cantidades de bacterias u hongos. Las soluciones de antibióticos concentrados pueden comprarse a 50 veces (50×) y 100 veces (100×) la concentración de trabajo.
Si bien los riesgos asociados con la preparación de antibióticos y su uso son relativamente bajos en el laboratorio de virología, la preparación y manipulación de antibióticos se ha asociado con reacciones de hipersensibilidad y dermatitis de contacto (115,116) y con asma (116–120) en trabajadores hospitalarios, farmacéuticos y veterinarios.
- Use siempre guantes, mascarilla y protección ocular al manipular antibióticos en polvo y al preparar o dispensar soluciones de antibióticos concentrados. En algunos casos, tal vez se necesite protección respiratoria (p. ej., campana de extracción de gases o mascarilla con presión positiva).
- Evite la generación de aerosoles al trabajar con antibióticos en polvo y soluciones porque esos aerosoles pueden contaminar el ambiente, sensibilizar a otros trabajadores del laboratorio (115) y representar un peligro para las personas sensibles a los antibióticos (115,116).
- No permita que personal del laboratorio con sensibilidad conocida a determinado antibiótico prepare soluciones de antibióticos concentrados.
- Tal vez también sea prudente excluir a las empleadas embarazadas de la preparación de soluciones de antibióticos concentrados, ya que los antibióticos pueden tener efectos adversos o desconocidos en el feto en desarrollo.
8.2.3. Soluciones de lejía (consulte 3.4.2)
8.2.4. Cicloheximida
La cicloheximida se utiliza como antibiótico, inhibidor de la síntesis de proteínas y regulador de crecimiento vegetal. En el laboratorio de virología, la cicloheximida se usa en medios de realimentación de Chlamydia.
- La cicloheximida en polvo y en solución es irritante y produce enrojecimiento, picazón y ardor. En estudios en animales se ha demostrado que la cicloheximida provoca efectos reproductivos adversos, incluidos defectos de nacimiento, toxicidad del esperma y daño testicular. Se desconoce si la cicloheximida puede tener efectos reproductivos similares en los humanos; por lo tanto, manipúlela como si fuera una toxina reproductiva. Consulte los documentos de la MSDS para obtener más información.
- El mayor potencial de exposición en el laboratorio se presenta al pesar la cicloheximida en polvo y durante la preparación de soluciones de cicloheximida. La cicloheximida puede ingresar al cuerpo en forma de aerosol y por vía oral mediante la exposición a polvo. La exposición también puede ocurrir por contaminación con las manos de alimentos, bebidas o cosméticos o en forma directa por tocarse la boca con las manos contaminadas.
- Manipule la cicloheximida en polvo en una campana de extracción de gases para productos químicos.
- Use equipo de protección personal (PPE) que incluya bata de laboratorio y guantes para manipular la cicloheximida en polvo y en solución, a fin de evitar la contaminación de la piel, la absorción en la piel y/o la exposición mano-boca. Lávese las manos con agua y jabón después de quitarse los guantes.
- Cómo desechar la cicloheximida
Las soluciones alcalinas (pH > 7,0) inactivan la cicloheximida. Aspirar el líquido de cultivos que contengan cicloheximida con un purgador de vació que contenga una solución 1:10 de lejía inactivará la sustancia química. La mayoría de los jabones y detergentes son alcalinos, y esos agentes también inactivarán la cicloheximida.
8.2.5. Dimetil sulfóxido (DMSO)
El dimetil sulfóxido (DMSO) se emplea como crioprotector al congelar cultivos celulares. El DMSO es un solvente potente y puede penetrar la piel y los guantes de látex.
- Minimice el contacto con la piel y las membranas mucosas.
- Use una bata de laboratorio y protección ocular al manipular soluciones de DMSO. Tal vez sea prudente usar guantes dobles ya que la sustancia química penetrará los guantes de látex con el correr del tiempo.
- El DMSO disuelve rápidamente los guantes de nitrilo, que son los que habitualmente se utilizan en laboratorios químicos.
- El DMSO penetra fácilmente la piel, y las sustancias disueltas en DMSO pueden absorberse rápidamente. Esa propiedad se ha usado como sistema para administración de fármacos, para permitir que los medicamentos antimicóticos penetren en la piel y las uñas de los dedos y de los pies. No obstante, en el laboratorio, la exposición al DMSO podría facilitar la absorción de contaminantes. Cuando el DMSO entra en contacto con la piel, algunas personas informan que notan rápidamente sabor a ostras o a ajo en la boca.
- El DMSO es mutagénico para células somáticas de mamíferos, bacterias y levaduras. La exposición a largo plazo puede provocar daño en la sangre, los riñones, el hígado, la piel, las membranas mucosas y los ojos. Consulte los documentos de la MSDS para obtener más información.
8.2.6. Tinciones, fijadores y tampones para microscopia electrónica
- El tetróxido de osmio y el glutaraldehído se usan como fijadores para microscopia electrónica. Los componentes líquidos y de vapor son fijadores potentes y fijarán rápidamente la piel, las membranas mucosas y los tejidos oculares del personal de laboratorio.
— Abra los viales en la campana de extracción de gases para productos químicos. Mantenga los viales en frascos dobles y selle las tapas con película tipo Parafilm.
— Manipule los viales con guantes desechables.
— Use protección ocular, guantes y batas de laboratorio desechables al manipular el fijador y fijar los tejidos. - El acetato de uranilo, el ácido fosfotúngstico y el molibdato de amonio se usan como tinciones negativas en el laboratorio de microscopia electrónica. Todos esos compuestos contienen metales pesados y son muy tóxicos si se los inhala, se los ingiere o si se introducen por cortes o abrasiones. El acetato de uranilo es débilmente radiactivo y los polvos deben guardarse en un recipiente de metal. El ácido fosfotúngstico es corrosivo y produce quemaduras en la piel y las membranas mucosas expuestas. El molibdato de amonio es muy peligroso en caso de contacto ocular, ingestión e inhalación.
— Los empleados de laboratorio deben usar PPE que incluya bata de laboratorio, guantes y protección ocular al manipular polvos y soluciones. Consulte los documentos de la MSDS para obtener más información.
— Prepare esas tinciones en una campana de extracción de gases para productos químicos, a fin de evitar la inhalación.
— Se debe tener precaución para evitar la contaminación de las áreas de trabajo con los polvos. - Los tampones para microscopia electrónica, como el cacodilato de sodio y el acetato de veronal, contienen arsénico y barbital sódico, respectivamente. Estos tampones se deben manipular con precaución.
— Prepare los tampones en una campana de extracción de gases para productos químicos, a fin de evitar la inhalación de polvos.
— Use PPE que incluya una bata de laboratorio, guantes y protección ocular al manipular polvos y soluciones. Consulte los documentos de la MSDS para obtener más información.
8.2.7. Medios de inclusión para microscopia electrónica
Los (met)acrilatos y los materiales a base de epoxi se usan con frecuencia para incluir muestras biológicas para microscopia electrónica. Los productos con epoxi incluyen Epon, Araldite, resina Spurr y Maraglas. Formvar (formal de polivinilo) se usa como película de sostén para cuadrículas de microscopia electrónica y para hacer réplicas. Muchos de esos compuestos son tóxicos, carcinogénicos o potencialmente carcinogénicos y han demostrado provocar irritación cutánea, dermatitis y sensibilización de la piel. Consulte los documentos individuales de la MSDS para ver más información.
- Use esos compuestos en áreas bien ventiladas, preferiblemente, en una campana de extracción de gases para productos químicos. Muchas de esas sustancias químicas se disuelven en solventes inflamables y deben mantenerse alejadas de fuentes de calor e ignición.
- Los monómeros penetran rápidamente los guantes de látex y de vinilo; cámbiese los guantes con frecuencia al realizar inclusiones con plásticos (121–124).
- Use guantes al manipular o recortar bloques incluidos en plástico. Es posible que no todos los monómeros de polimericen, y los monómeros no polimerizados conservarán sus propiedades tóxicas.
- Cubra las áreas de trabajo con toallas de papel o almohadillas absorbentes recubiertas en plástico y limpie los derrames inmediatamente con alcohol.
- Use agua y jabón para eliminar cualquier resina que entre en contacto con la piel. No use alcohol para eliminar resinas de la piel, ya que el alcohol aumenta la penetración de la resina.
- Cómo desechar medios de inclusión y soluciones para formar películas Los materiales de inclusión suelen ser menos peligrosos cuando están polimerizados o endurecidos.
— Nunca vierta soluciones que contengan plástico (p. ej., mezcla de óxido de propileno y Epon) por el desagüe. Estas se solidificarán en el desagüe y pueden taparlo.
— Solidifique todos los residuos antes de desecharlos. Coloque los residuos solidificados en una campana de extracción de gases y deseche el recipiente como residuos peligrosos.
— Guarde los recipientes, vasos de precipitado, viales, pipetas y cualquier instrumento desechado que hayan estado en contacto con resinas o películas de sostén en recipientes resistentes a punciones en la campana de extracción de gases hasta que puedan despacharse como residuos peligrosos.
8.2.8. Bromuro de etidio
El bromuro de etidio (EtBr) es un agente intercalante de ADN que se utiliza comúnmente como marcador no radiactivo para visualizar bandas de ácidos nucleicos en electroforesis y otras separaciones a base de gel. El EtBr es un mutágeno potente, es tóxico después de la exposición aguda y es un irritante para la piel, ojos, boca y vías respiratorias superiores.
- Manipule el EtBr puro en una campana de extracción de gases para productos químicos, ya que el polvo puede contaminar fácilmente todo el laboratorio.
- Designe un área en la que se realizará el trabajo con EtBr y use soluciones de EtBr únicamente en esa área.
- Cubra las superficies del área designada con una almohadilla absorbente recubierta en plástico. Reemplace la almohadilla según un cronograma o cuando se contamine.
- Use PPE que incluya una bata de laboratorio, protección ocular y guantes al manipular soluciones y geles de EtBr.
Nota: Los guantes de látex brindan poca protección contra el EtBr. Los guantes de nitrilo brindan una barrera efectiva a corto plazo. Los guantes dobles aumentan la protección. - Lávese las manos minuciosamente después de quitarse los guantes.
- La aplicación de soluciones de hipoclorito de sodio a soluciones usadas de EtBr desactivará el bromuro de etidio, pero los productos de reacción son mutagénicos según el ensayo de Ames (125). Use un método de desactivación alternativo o use una planta autorizada de tratamiento de residuos peligrosos para desechar las soluciones usadas.
- Tampoco se recomienda el uso de soluciones de hipoclorito de sodio en las áreas de trabajo en las que se emplea el EtBr.
- Gestión de residuos de EtBr
— Recolecte y trate incluso los pequeños volúmenes o concentraciones de residuos de EtBr como residuos peligrosos o siga las reglamentaciones locales.
— Coloque en una bolsa los materiales que hayan estado en contacto con EtBr y deséchelos como residuos químicos peligrosos.
— Minimice los volúmenes de solución de EtBr agregando carbón activado. El carbón se puede recoger por filtración y colocarse en recipientes resistentes a fugas para desecho de residuos peligrosos.
— Coloque geles de agarosa que contengan EtBr en un recipiente de plástico resistente a fugas y deséchelos como residuos peligrosos.
8.2.9. Azul de Evans
El azul de Evans se emplea como contratinción durante la microscopia de fluorescencia. Los polvos y soluciones de azul de Evans son irritantes cutáneos pero existen advertencias conocidas de inflamabilidad, carcinogenicidad o teratogenicidad asociadas con este compuesto.
- El mayor potencial de exposición en el laboratorio se presenta al pesar el azul de Evans en polvo y durante la preparación de soluciones. Inhalar los polvos puede provocar irritación respiratoria. También se puede producir irritación de la piel y las membranas mucosas.
- Manipule el azul de Evans en una campana de extracción de gases para productos químicos, a fin de evitar la inhalación.
- Use PPE que incluya bata de laboratorio, protección ocular y guantes al manipular polvos y soluciones de azul de Evans, a fin de evitar la contaminación de la piel.
8.2.10. Soluciones de guanidinio
El cloruro de guanidinio, el tiocianato de guanidinio y el isotiocianato de guanidinio son agentes caotrópicos usados para alterar células y desnaturalizar proteínas (en especial ARNasas y ADNasas) durante los procedimientos de extracción de ácidos nucleicos.
Esas sustancias químicas son irritantes potentes y la exposición ocular puede producir enrojecimiento, irritación y dolor. Son tóxicas si se las ingiere y pueden provocar alteraciones neurológicas. Si se inhalan, los compuestos de guanidinio pueden provocar tos por irritación de las vías respiratorias y falta de aire.
- Manipule los polvos de guanidinio en una campana de extracción de gases para productos químicos, a fin de evitar la inhalación.
- Use PPE que incluya una bata de laboratorio, guantes y protección ocular al manipular polvos y soluciones.
- No agregue lejía a ningún residuo de muestra que contenga tiocianato de guanidinio debido a la producción de gases tóxicos. Los compuestos de guanidinio son reactivos con ácidos y otros oxidantes, con los que producen gases tóxicos que incluyen vapores de cianuro (derivados de tiocianato e isotiocianato), vapores de ácido clorhídrico (clorhidrato de guanidinio) y óxidos de nitrógeno (todas las formas).
8.2.11. Rojo neutro
El rojo neutro es un indicador de pH y una tinción fundamental empleada en algunos ensayos de placa. Puede ser perjudicial si se traga, inhala o absorbe por la piel y puede provocar irritación de la piel, los ojos y las vías respiratorias.
- Manipule el rojo neutro en una campana de extracción de gases para productos químicos, a fin de evitar la inhalación.
- Use PPE que incluya bata de laboratorio y guantes al manipular polvos y soluciones de rojo neutro, a fin de evitar la contaminación de la piel.
- El mayor potencial de exposición en el laboratorio se presenta al pesar el rojo neutro en polvo y durante la preparación de soluciones.
8.2.12. Merthiolate (timerosal)
El Merthiolate, o timerosal, es un agente antiséptico y antimicótico que contiene mercurio y se usa como conservante en algunas soluciones de laboratorio. El timerosal concentrado es muy tóxico cuando se lo inhala o ingiere o en contacto con la piel.
- Use PPE que incluya bata de laboratorio y guantes al manipular polvos y soluciones de Merthiolate, a fin de evitar la exposición de la piel y las membranas mucosas.
- Las bajas cantidades usadas en algunos reactivos comerciales son relativamente seguras, pero la exposición al timerosal puede tener efectos acumulativos. En el cuerpo, el Merthiolate es metabolizado o degradado a etilmercurio (CHHg+) y tiosalicilato. El etilmercurio se elimina de la sangre en un tiempo medio de alrededor de 18 días, y del cerebro en alrededor de 14 días.
8.2.13. Solventes orgánicos
- La acetona es el principal solvente orgánico usado en el laboratorio de virología y se utiliza, principalmente, como fijador para frotis celulares.
- La acetona es inflamable y se clasifica como irritante, ya que produce daño ocular e irritación de la piel y las vías respiratorias. La exposición a largo plazo puede producir daños reproductivos, del sistema nervioso, renales, hepáticos y cutáneos.
- Guarde las acetonas en un gabinete de almacenamiento para material inflamable y manténgalas lejos de fuentes de calor, chispas o llamas. No guarde ni use acetona en un refrigerador que no esté clasificado como a prueba de explosiones. Las chispas de la bomba del refrigerador y del interruptor de la luz que se activa al abrir la puerta pueden encender los gases de acetona y provocar una explosión.
- Use las acetonas en un área bien ventilada (o con una campana de extracción de gases para productos químicos), a fin de evitar la irritación respiratoria.
- No use guantes de vinilo para manipular acetonas y otros solventes orgánicos agresivos, ya que esos agentes pueden disolver los guantes de vinilo.
- Los guantes de látex se disolverán con la acetona con el paso del tiempo y se recomienda el uso de guantes dobles para el manipular acetona durante períodos breves.
- Las acetonas disuelven o empañan muchos plásticos y se debe tomar la precaución de proteger los dispositivos de plástico de la exposición a acetonas.
- Microscopia electrónica
— Muchos solventes volátiles, incluidos etano, óxido de propileno y éteres, se usan en el laboratorio de microscopia electrónica. Esos solventes son extremadamente inflamables y constituyen peligros de incendio y explosión. Se deben tomar precauciones para evitar descargas estáticas que podrían encender las sustancias químicas.
— Use estos solventes con una campana de extracción de gases para productos químicos, a fin de evitar la irritación respiratoria y minimizar la acumulación de vapores explosivos.
— Use PPE que incluya una bata de laboratorio, protección ocular y guantes resistentes a sustancias químicas al manipular esas sustancias.
— Tal vez sea prudente desconectar las cañerías de gas inflamable que vayan a los laboratorios de microscopia electrónica para desalentar el uso de llamas abiertas.
— Guarde pequeñas cantidades en gabinetes de almacenamiento para material inflamable y mantenga estos reactivos lejos de fuentes de calor, chispas o llamas.
8.2.14. Azida sódica
La azida sódica es un conservante común en muchos reactivos de laboratorio, incluidos anticuerpos monoclonales, tampones y reactivos de inmunoensayos enzimáticos.
- La azida sódica es una toxina aguda y un mutágeno. Reduzca todo el contacto con esta sustancia al mínimo nivel posible.
- La azida sódica y el ácido hidrazoico (HN, que se forma a partir de NaN en agua) han demostrado producir hipotensión (presión arterial baja) en animales de laboratorio y en humanos, y formar complejos fuertes con la hemoglobina, con lo que se bloquea el transporte de oxígeno en la sangre.
- Use PPE que incluya guantes, bata de laboratorio y protección ocular al manipular soluciones que contengan azida sódica.
- La azida sódica no es explosiva excepto cuando se la calienta a la temperatura de descomposición (300 °C) o se combina con metales.
- Nunca deseche soluciones de azida sódica sólidas o concentradas por el desagüe ya que esa práctica puede provocar incidentes graves cuando la azida reacciona con el plomo o cobre de las tuberías de desagüe y explota.
- Las soluciones diluidas (0,1 %) que se encuentran en la mayoría de los reactivos de laboratorio se pueden desechar por el desagüe con abundante volumen de agua para evitar la acumulación de azida metálica. La azida sódica reacciona con metales pesados (como plata, oro, plomo, cobre, latón o las soldaduras de los sistemas de cañerías) y sales metálicas, y forma compuestos muy explosivos, como azida de plomo y azida de cobre. Esas azidas metálicas pueden explotar al reparar o golpear las cañerías.
- Se ha asignado la designación “piel” a los Límites de exposición permisibles de la Administración de Seguridad y Salud Ocupacionales (OSHA) debido a la capacidad de la azida sódica de penetrar rápidamente la piel intacta. La exposición dérmica puede contribuir considerablemente a la exposición total a azida sódica.
- La azida sódica no es compatible y puede reaccionar violentamente con cloruro de cromilo, hidrazina, bromina, disulfuro de carbono, dimetil sulfato, dibromomalonitrilo, ácidos potentes (como ácido clorhídrico, sulfúrico y nítrico) y cloruros de ácido.
8.3. Manipulación de cultivos celulares en la mesa
- Todos los cultivos celulares, ya sea que estén inoculados con muestras clínicas o no, son potencialmente infecciosos. Se han hallado agentes virales no previstos o adventicios en muchas líneas celulares, células diploides y cultivos primarios (Tabla 9). Los agentes adventicios pueden diseminarse durante las manipulaciones de cultivos celulares y pueden originarse de
— tejido primario, cultivos secundarios o líneas celulares con infección latente o persistente;
— productos animales como suero fetal bovino y tripsina o
— agentes transformadores (virus del papiloma humano [human papilloma virus, HPV], SV-40, virus del herpes, retrovirus, adenovirus y otros) usados para inmortalizar células. - Muchos de esos agentes pueden no ser detectados porque no producen efectos citopáticos; por lo tanto, el pasaje y archivo celular puede perpetuar esos agentes durante generaciones.
8.3.1. Líneas celulares
- Los cultivos primarios de tejidos, células y sangre humana (y potencialmente animal) presentan el mayor riesgo de albergar agentes infecciosos no previstos o adventicios que podrían infectar a los humanos. Como resultado, la OSHA incluyó las líneas celulares humanas en su Dictamen final sobre patógenos transmitidos por la sangre (Final Rule on Bloodborne Pathogens) (33). Aunque el estándar de la OSHA CFR 29, Patógenos transmitidos por sangre, se refiere a sangre y tejidos humanos, se recomienda respetar estos estándares en el laboratorio veterinario. Realice los procedimientos de cultivo de tejidos en un BSC clase II.
- Las células y tejidos de primates también conllevan riesgos para los empleados de laboratorio. SV-5 y SV-40 son contaminantes frecuentes de las células renales primarias del macaco rhesus, y los cultivos de macacos y otros monos del Viejo Mundo podrían presentar infección latente por Herpesvirus simiae (virus B). La infección por virus B presenta un peligro que suele ser fatal para el personal que manipula esos animales y sus tejidos.
- Los cultivos de ratones desnudos y con inmunodeficiencia combinada grave (severe combined immune deficient, SCID) presentan un riesgo especial de albergar agentes que podrían provocar infecciones subclínicas o crónicas en el personal de laboratorio.
- Ciertas líneas celulares se inmortalizaron con agentes virales como SV-40, virus de Epstein-Barr, adenovirus o HPV. Esas células pueden producir virus infecciosos o pueden tener material genómico viral dentro de las células. Otras líneas celulares pueden transportar elementos genéticos virales que se introdujeron intencionalmente durante experimentos o accidentalmente durante la manipulación de los cultivos. Esos virus y elementos genéticos virales sobreviven a la congelación y pueden estar presentes en materiales de cultivo archivados. Muchas líneas celulares también presentan infección persistente por retrovirus con amplio espectro de huéspedes, que pueden representar un peligro de infección para los empleados de laboratorio.
- Las células humanas tumorigénicas pueden presentar un posible peligro por autoinoculación (126–129). Los tumores o células tumorales inoculados a ratones desnudos pueden adquirir agentes adventicios adicionales, como el virus de la coriomeningitis linfocítica (lymphocytic choriomeningitis virus, LCMV).
- Muchos de los virus adventicios no producen efectos citopáticos ni alteran el fenotipo celular, y muchos pueden sobrevivir la congelación y el almacenamiento en nitrógeno líquido durante largos períodos.
- Cuando se cultivan células tumorales infectadas, los líquidos de sobrenadante pueden contener virus infecciosos y el laboratorio puede optar, opcionalmente, por tratar esos líquidos como residuos con peligro biológico. EL LCMV constituye un problema en particular para las mujeres embarazadas ya que el virus puede transmitirse al feto y provocar muerte fetal o malformación grave del sistema nervioso central.
8.3.2. Prácticas para cultivos celulares
Los trabajadores que manipulan o manejan células humanas o de animales corren el riesgo de posible exposición a agentes latentes y adventicios potencialmente infecciosos que pueden estar presentes en esas células y tejidos. Las prácticas para cultivos celulares recomendadas de los CDC/Institutos Nacionales de Salud (1) incluyen las siguientes.
- Seguir estrictamente las recomendaciones de BSL-2 en cuanto al PPE, como batas de laboratorio, guantes y protección ocular.
- Manipular las células humanas y de otros primates usando prácticas y contención de BSL-2.
- Realizar todo el trabajo en un BSC clase II o superior. Los gabinetes de seguridad clase I y las mesas limpias nunca se usan para manipulación de cultivos celulares porque no brindan una protección adecuada al operador.
- Pasar por autoclave o desinfectar todo el material que entre en contacto con los cultivos celulares antes de desecharlo.
- Inscribir a todo el personal del laboratorio que trabaje con células y tejidos humanos en un programa de medicina ocupacional específico para patógenos transmitidos por sangre, y trabajar de acuerdo con las políticas y pautas establecidas por el plan de control de exposiciones de la institución.
- Determinar si es necesario que el personal de laboratorio que trabaja con células y tejidos humanos proporcione una muestra de suero basal (si esta es una política institucional basada en una evaluación de riesgos), si se debe ofrecer vacunación contra la hepatitis B y si es necesaria una evaluación por parte de un profesional de la atención médica tras un incidente de exposición (1). Se recomienda aplicar programas similares para las personas que trabajan con sangre, fluidos corporales y demás tejidos de primates no humanos.
8.3.3. Peligros biológicos asociados con la lectura de cultivos celulares
- El medio seco del borde de los tubos de cultivo podría presentar un peligro de contaminación. Manipule todos los recipientes de cultivo como si estuvieran contaminados.
— Use guantes y una bata de laboratorio al manipular cultivos virales.
— Use protección ocular si existe el peligro potencial de salpicaduras.
— Realice todas las manipulaciones de cultivos en un BSC.
— Descontamine los tubos de cultivo y demás materiales que entren en contacto con los cultivos celulares antes de desecharlos, mediante un método eficaz (por lo general, autoclave o desinfección química) (1). - Los viales Shell, tubos y otros cultivos pasan por múltiples manipulaciones (p. ej., aspiración de medios, realimentación, inoculación) que pueden generar aerosoles. Esos aerosoles y manipulaciones pueden contaminar el exterior del recipiente de cultivo.
- Un tubo aislado que gotee hacia otro estante también podría contaminar el exterior de los recipientes ubicados en los estantes que están debajo y es posible que no deje evidencia visible de la contaminación.
8.3.4. Peligros biológicos asociados con el uso de nitrógeno líquido
El nitrógeno líquido puede contaminarse cuando las ampollas se rompen en el recipiente Dewar, y los contaminantes se pueden conservar en el nitrógeno (23). Esos contaminantes potencialmente infecciosos pueden contaminar otros viales colocados en el recipiente Dewar y generar un aerosol infeccioso a medida que el nitrógeno líquido se evapora. Se recomiendan los criotubos de plástico aptos para temperaturas de nitrógeno líquido para el almacenamiento de nitrógeno líquido, ya que parecen ser más resistentes que las ampollas de vidrio y es menos probable que se rompan en el nitrógeno. No se recomiendan las ampollas de vidrio.
Las ampollas y criotubos pueden explotar cuando se retiran del nitrógeno líquido y crear aerosoles y gotas infecciosos. Consulte la Sección 3.9 para ver información adicional.
8.4. Precauciones personales
Ningún grado de ingeniería de seguridad puede reducir los riesgos físicos, químicos y biológicos en un laboratorio si no se toman precauciones personales en forma sistemática y rigurosa. Todos los empleados de laboratorio y los visitantes son responsables de seguir los procedimientos establecidos en cuanto a precauciones personales. Los directores y supervisores deben revisar periódicamente sus responsabilidades en cuanto a bioseguridad (1).
8.4.1. Gabinete de seguridad biológica
- Realice todas las manipulaciones de cultivos del laboratorio de virología en un BSC clase II. Esas manipulaciones incluyen, entre otras, inoculación de cultivos, alimentación, pasaje, análisis de hemadsorción y hemaglutinación, diluciones y titulaciones virales, fijación celular, tinción inmunofluorescente y preparación de controles y portaobjetos de control.
- Respete la preparación adecuada del BSC y los procedimientos operativos (1). Consulte la Sección 3 y la Tabla 5 para ver las pautas sobre el uso de los BSC y las descripciones de las características y usos de los tipos de BSC.
- Certifique los BSC según la Norma 49 de NSF/ANSI anualmente o después de mover el gabinete, de cambiar o desinfectar los filtros HEPA o de que se haya hecho cualquier reparación importante a la unidad que pudiera afectar el emplazamiento o el desempeño del sistema de filtración HEPA.
- Retire el contenido del BSC y desinfecte el interior del BSC a diario o después de un derrame o un evento de contaminación.
— No use alcoholes como desinfectante principal de superficies en los BSC, ya que los alcoholes tienen un efecto escaso o nulo en los virus sin envoltura. Los vapores del alcohol isopropílico pueden ser tóxicos y provocar dermatitis de contacto. Una solución 1:10 de lejía brinda la mejor actividad desinfectante, pero se debe tener cuidado y remover todo el cloro residual con agua, ya que, con el tiempo, el cloro corroerá las superficies de acero inoxidable.
— Retire la placa del piso del gabinete y la rejilla frontal una vez al mes o dos veces al mes para su limpieza. Desinfecte la placa del piso, la rejilla y el pleno debajo de la placa del piso.
— Limpie las superficies de trabajo, las paredes interiores y la superficie interior de la ventana con una solución 1:10 de lejía doméstica (1), seguido por una limpieza con agua para eliminar el cloro residual y una limpieza con etanol al 70 % (EtOH). Retire el cloro residual ya que, con el tiempo, corroerá las superficies de acero inoxidable.
— Limpie cualquier objeto que se volverá a colocar en el BSC.
— Deje el extractor funcionando durante al menos 4 minutos para eliminar cualquier partícula.
— En algunos laboratorios, dejan la puerta abierta y los extractores en funcionamiento en todo momento, mientras que en otros se apaga el extractor y se cierra la puerta (si existe) al final del día.
8.4.2. Equipo de protección personal
- La mayoría de las recomendaciones para el laboratorio general de microbiología son apropiadas para el laboratorio de virología (Sección 3).
- Deben usarse guantes para proteger las manos de la exposición a materiales peligrosos y temperaturas extremas. En el área de biología molecular, los guantes también se usan para proteger a las muestras de las nucleasas que están en la piel. Consulte las Secciones 8.1–4 para ver las pautas sobre el uso de guantes o PPE al manipular tinciones o sustancias químicas específicas.
8.4.3. Desinfección
Las pautas de desinfección para el laboratorio general de microbiología son aplicables al laboratorio de virología (Sección 3).
8.5. Descontaminación y desecho de residuos de laboratorio
- Desinfecte los reactivos o materiales que entren en contacto con muestras clínicas, cultivos celulares o cultivos virales (incluidos los guantes y el PPE) antes de introducirlos en el flujo de residuos médicos. Los líquidos se pueden desinfectar tratándolos con una solución 1:10 de lejía doméstica (Sección 3.4.2 y 3.5) o mediante autoclave. Desinfecte todos los demás materiales mediante autoclave antes de colocarlos con los residuos médicos.
- Descontamine las muestras, reactivos, cultivos y equipo que entre en contacto con las muestras de los pacientes con sospecha de Creutzfeldt-Jakob, o cualquier otra enfermedad asociada con priones, siguiendo los protocolos locales, generalmente mediante el uso de autoclave durante 1 hora en presencia de soluciones de hipoclorito de 20.000 ppm o NaOH 1 N (1).
8.6. Áreas limpias en comparación con áreas sucias del laboratorio
- En el laboratorio de virología, la distinción entre áreas sucias y limpias no es un nombre apropiado; todas las áreas del laboratorio presentan mayores oportunidades de encontrar peligros infecciosos, químicos y físicos. Las precauciones de laboratorio se aplican a todas las áreas del laboratorio.
- Las áreas de preparación de cultivos celulares y de preparación de reactivos suelen llamarse áreas “limpias” porque allí no se permiten muestras, ácidos nucleicos amplificados ni materiales de control. El objetivo de establecer y controlar esas áreas “limpias” es evitar la contaminación de reactivos y cultivos celulares que podría producir resultados falsos. Estas son áreas de laboratorio y las precauciones de laboratorio siguen siendo válidas.
8.7. Reconocimiento temprano de organismos de alto riesgo
Los análisis de laboratorio clínico de rutina pueden aportar la primera evidencia de un evento inesperado de bioterrorismo, y las muestras clínicas de rutina también pueden contener agentes infecciosos inusuales o exóticos cuya amplificación en cultivos es peligrosa. El reconocimiento temprano de esos posibles organismos de alto riesgo es fundamental, al igual que lo es respetar todos los principios básicos de seguridad en el laboratorio. Se enumeran los eventos que requieren la intervención de un supervisor o del director del laboratorio (Tabla 10). Si bien la mayoría de los eventos son causados por acciones accidentales y no implican un riesgo, los tecnólogos y directores de laboratorio deben estar al tanto de que podría haber causas de alto riesgo. La forma en que el laboratorio responde a esos eventos desencadenantes dependerá de si el laboratorio tiene instalaciones BSL-3 y de la capacidad de la red estatal y local de respuesta del laboratorio (laboratory response network, LRN).
8.7.1. Mesa de análisis con anticuerpos fluorescentes
- La tinción débil de células cuando los frotis de control y otras muestras positivas muestran una tinción fuerte puede deberse a una escasa expresión de antígenos, a toma de muestras de lesiones costrosas y degradación celular. También puede haber tinción débil cuando el reactivo del anticuerpo presenta reacción cruzada con un epítopo antigénico similar que surge de la variación antigénica, por presencia de una subespecie viral o por un virus no sospechado. Este tipo de reacción se da con más frecuencia al realizar tinciones con anticuerpos policlonales.
- Un patrón de tinción inusual (p. ej., tinción citoplasmática moteada con un reactivo que, generalmente, produce tinción nuclear) puede indicar la presencia de un virus no sospechado.
- La tinción de un tipo de célula inusual (p. ej., tinción de células escamosas en lugar de células ciliadas del epitelio del aparato respiratorio) podría indicar la presencia de un virus diferente o de un virus esperado con alteración de tropismo.
- Notifique esos hallazgos al supervisor o director del laboratorio.
8.7.2. Resultados sospechosos o inusuales
- Los agentes conocidos de bioterrorismo o las emergencias de salud pública, como la enfermedad de pie y boca, flavivirus, viruela, virus alfa y virus de fiebre hemorrágica, pueden crecer en los cultivos celulares de rutina usados en el laboratorio clínico. Si un cultivo produce un patrón de efecto citopático (cytopathic effect, CPE) que es compatible con uno de esos agentes, no lo abra para continuar el análisis. Comuníquese con el médico o veterinario tratante para recibir más información sobre el paciente/animal y comuníquese con la LRN local de laboratorios para recibir más instrucciones.
- Los cultivos que producen un patrón de CPE conocido en un tipo de célula inusual y/o un resultado de CPE inesperado de una fuente de muestra específica (p. ej., una muestra ocular que produce redondeo hipertrófico en casi todos los tipos celulares) pueden indicar la presencia de un virus alterado o inesperado. Comuníquese con el médico o veterinario para recibir más información y pase la muestra al laboratorio BSL-3 para continuar con el análisis.
- La confirmación del fracaso del análisis puede ser causada por la variación antigénica o por un error del operador cometido durante el análisis. Pueden usarse análisis confirmatorios alternativos, como reacción en cadena de la polimerasa (PCR), ya que los métodos de PCR por lo general presentan menos riesgos que la tinción adicional con anticuerpos fluorescentes. Si el análisis por PCR no permite identificar el virus, pase el cultivo al laboratorio BSL-3 para continuar el análisis.
- Si no se dispone de un laboratorio BSL-3, comuníquese con la LRN estatal o local de laboratorios para recibir ayuda con la identificación del agente viral.
8.7.3. Análisis de ácidos nucleicos
- Las muestras que producen una alteración en la forma de la curva de fusión, demasiados picos y/o una alteración en la temperatura de fusión (Tm) cuando los controles y las curvas de otros pacientes son normales podrían indicar una mala extracción, la presencia de dímeros de cebadores o cambios genéticos por los cebadores o las sondas. Esos resultados también pueden ser producto de la presencia de un patógeno inesperado o inusual (quimérico, recombinante o reordenante). Una nueva extracción y análisis presenta un modesto riesgo adicional. Si los resultados siguen siendo inusuales, la muestra debe derivarse a la LRN de laboratorios para continuar los análisis.
- Las muestras para PCR con alteración de las pendientes de amplificación pueden ser producto de variaciones genéticas bajo los cebadores y/o sondas o de la presencia de un patógeno inusual. Una nueva extracción y análisis presenta un modesto riesgo adicional. Si los resultados siguen siendo inusuales, el laboratorio debe derivar la muestra a su LRN estatal o local para su caracterización adicional.
8.8. Riesgos asociados con el laboratorio de microscopia electrónica
La microscopia electrónica de diagnóstico puede ser un método relativamente simple y rápido para la identificación morfológica de los agentes de una muestra. Los procedimientos de microscopia electrónica pueden servir como método de detección general de organismos nuevos u organismos con propiedades genéticas o inmunológicas alteradas que los vuelven indetectables mediante protocolos con ácidos nucleicos o inmunoensayos (192). Los laboratorios de microscopia electrónica comparten muchos de los peligros físicos, químicos y biológicos descritos para el laboratorio de virología, pero también tienen algunas características que les son propias.
8.8.1. Líquidos inflamables y combustibles
En el laboratorio de microscopia electrónica se utilizan diversos solventes inflamables, y no se recomienda el uso de llamas abiertas (consulte la Sección 8.2.13).
- Coloque los solventes que requieran refrigeración en refrigeradores especiales para almacenar materiales inflamables que minimicen las conexiones eléctricas expuestas y reduzcan la oportunidad de que se generen chispas.
- Guarde los líquidos inflamables en gabinetes para almacenar materiales inflamables de acuerdo con las reglamentaciones locales y estatales.
- Manipule los líquidos inflamables en campanas de extracción de gases para minimizar la acumulación de vapores. La limpieza mediante ultrasonido de los montajes del cilindro de Wehnelt en los baños de acetona debe realizarse en una campana de extracción de gases para productos químicos.
- Nunca vierta líquidos inflamables por el desagüe porque pueden producir una explosión.
8.8.2. Peligros de los rayos X
El microscopio electrónico genera niveles peligrosos de rayos X dentro del microscopio cuando los electrones de alta energía chocan contra los componentes de metal. Los microscopios electrónicos modernos tienen suficiente protección y puertos de visión impregnados en plomo que minimizan los peligros para el operador. No obstante, las modificaciones al instrumento, agregar y retirar accesorios y algunos procedimientos de mantenimiento pueden comprometer la protección.
- Use un contador Geiger-Müller (GM) calibrado de ventanilla muy delgada para verificar la eficacia de la protección y vigilar los niveles de radiación
— inicialmente, al momento de la instalación;
— siempre que se modifique el microscopio y
— periódicamente, según lo indiquen las políticas estatales, locales o institucionales. - Los niveles de radiación deben ser < 0,5 mR a 5 centímetros de la unidad.
8.8.3. Peligros eléctricos
Consulte la Sección 3.7 para ver información sobre seguridad eléctrica de rutina en el laboratorio de microscopia electrónica.
- Se utilizan fuentes eléctricas especiales de alto voltaje y alto amperaje para alimentar los microscopios electrónicos y otros equipos del laboratorio. Solo los técnicos capacitados deben realizar el servicio técnico de esos equipos. Instale trabas de seguridad e interruptores de la alimentación para evitar la activación de los circuitos eléctricos mientras se está haciendo el servicio técnico del instrumento.
- Cambiar el filamento del disparador de electrones de alto voltaje puede implicar un peligro eléctrico si la jabalina de puesta a tierra no hace contacto con la tapa de Wehnelt. Se puede acumular una carga considerable en el cilindro, la que se debe eliminar antes de tocar el cilindro.
8.8.4. Peligros químicos
En el laboratorio de microscopia electrónica se usan varias tinciones con metales pesados y fijadores agresivos. Consulte la Sección 8.2 y los materiales de las MSDS proporcionados por el fabricante para ver las pautas para manipular tinciones y fijadores. Los materiales de inclusión y formación de película constituyen peligros químicos y muchos de esos materiales se disuelven en solventes orgánicos inflamables.
- Limite la exposición aguda y a largo plazo a esas sustancias químicas.
- Coloque los hornos para inclusión en una campana de extracción de gases para productos químicos a fin de minimizar la exposición a posibles peligros químicos.
- Los guantes de látex no son apropiados para todas las sustancias químicas, y debe enfatizarse el uso de guantes adecuados con todo el personal del laboratorio.
8.8.5. Gases criogénicos y comprimidos
Los gases criogénicos usados con mayor frecuencia en el laboratorio de microscopia electrónica son el nitrógeno líquido y el helio líquido. También se usan helio, CO y nitrógeno comprimidos. Los peligros y las medidas de seguridad asociadas con esos gases se resumen en las Secciones 3.8 y 3.9.
8.8.6. Equipos especializados
En el laboratorio de microscopia electrónica se emplean varios instrumentos especializados cuyo uso puede ser peligroso. Por ejemplo, en los evaporadores, liofilizadores, criofractura y unidades de recubrimiento con atomización emplean vacío y los recipientes podrían implosionar. Los peligros de implosión se repasan en la Sección 3.13.1.
- Para evitar el daño ocular durante la evaporación, use gafas de soldadura para ver la fuente.
- Espere a que los componentes se enfríen antes de tocarlos.
- No inhale ninguno de los metales evaporados que podrían desprenderse de la superficie.
- Los secadores de punto crítico pueden ser bastante peligrosos debido a la alta presión generada dentro de la “bomba” (121,193). Siga los procedimientos operativos y de seguridad descritos en el manual del operador para emplearlos en forma segura.
— Coloque una lámina protectora Lexan de media pulgada de grosor entre el operador y la bomba.
— No fije el protector directamente sobre la ventana de la bomba, donde podría recibir el impacto completo de una explosión. Ese impacto podría destruir el protector.
— También se recomienda el uso de un protector facial de policarbonato al observar el contenido de la bomba.
— Ventile los freones o sustitutos de freón de los secadores de punto crítico directamente al exterior o mediante una campana de extracción de gases.
8.8.7. Peligros biológicos
Los peligros biológicos del laboratorio de microscopia electrónica son similares a los del laboratorio de virología, y deben emplearse buenas prácticas de laboratorio.
- Realice la manipulación primaria de las muestras en un gabinete de seguridad biológica para evitar los aerosoles y la contaminación del laboratorio.
- Es posible que las soluciones de tinción negativa no inactiven microorganismos y virus. El tetróxido de osmio es un esterilizador eficaz, pero no puede usarse con todas las muestras.
8.9. Análisis rápidos (kits)
Existen varios análisis rápidos de inmunodiagnóstico aprobados por la FDA para anticuerpos y antígenos virales. Diseñados en principio para realizar análisis en el punto de atención o cerca del punto de atención, muchos de estos análisis ahora se usan en los laboratorios clínicos de virología. Las siguientes recomendaciones de bioseguridad se basan en la orientación de bioseguridad de los CDC para la manipulación de muestras o aislados clínicos del virus de la gripe A H1N1 de 2009 (194).
- Los procedimientos que solamente implican pasos simples, como insertar un hisopo en un medio o transferir muestras y reactivos con pipetas, y de los que no se espera razonablemente que generen aerosoles, se pueden realizar en la mesa utilizando protección contra salpicaduras solamente. Use el BSC para los procedimientos de análisis que requieren centrifugación, procesamiento con vórtice, mezcla vigorosa u otros métodos que podrían generar aerosoles.
- Realice los análisis en la mesa de forma tal que se eviten las salpicaduras y la generación de aerosoles. El PPE apropiado para este tipo de análisis consiste en bata de laboratorio, guantes, protección ocular y mascarilla facial, como mascarilla quirúrgica, odontológica, para procedimientos médicos, de aislamiento o para procedimientos con láser. Un protector contra salpicaduras que brinde protección a todo el rostro sustituye la necesidad de usar protección ocular y una mascarilla facial por separado.
- Descontamine las superficies de trabajo y el equipo con una solución 1:10 de lejía lo antes posible después de haber procesado las muestras.
- Si se realiza en un BSC clase II, el análisis rápido de inmunodiagnóstico no requiere el uso de protección ocular y mascarilla facial adicionales.
8.10. Laboratorio molecular
Los laboratorios de virología molecular comparten muchos de los peligros físicos, químicos y biológicos descritos para el laboratorio de virología, pero también comportan algunos peligros que les son propios.
8.10.1. Peligros eléctricos
Consulte la Sección 3.7 para ver información sobre seguridad eléctrica de rutina en el laboratorio de virología molecular. En los equipos de electroforesis y secuenciación de ácidos nucleicos se emplean fuentes de alimentación especiales de alto voltaje.
- Nunca utilice equipo eléctrico de alto voltaje cerca de líquidos y gases inflamables, ya que un arco podría causar una explosión o un incendio.
- Desconecte la alimentación del equipo de electroforesis antes de desmontar el aparato.
- Solo los técnicos capacitados deben realizar el servicio técnico de los equipos eléctricos de alto voltaje.
- Nunca fuerce o anule las trabas de seguridad y los interruptores de la alimentación del equipo de electroforesis.
8.10.2. Peligros de la luz ultravioleta
- A menudo se usan cajas de visión con luz ultravioleta (UV) de onda corta para visualizar bandas de ácidos nucleicos en geles. Debe prestarse especial atención a la protección de los ojos y a cubrir completamente la piel al visualizar y fotografiar geles en una cámara de visualización UV.
- Use guantes, bata de laboratorio de mangas largas y protector facial completo resistente a luz UV al trabajar con cámaras de visualización UV.
- Use únicamente protectores faciales aptos para luz UV de onda corta para este fin.
- Ubique las cámaras de visualización UV fuera de las áreas de tránsito normales del laboratorio, de modo que las personas no involucradas o que pasan por el lugar no estén expuestas la luz ultravioleta. En la Sección 3.12 se analizan otros peligros de la luz UV.
8.10.3. Peligros químicos
Los peligros químicos exclusivos del laboratorio de virología molecular incluyen el uso de reactivos para extracción a base de cloroformo, bromuro de etidio (Sección 8.2.8) y guanidinio (Sección 8.2.10). Evite la exposición aguda y a largo plazo a esas sustancias.
8.10.4. Peligros biológicos
Los peligros biológicos del laboratorio de virología molecular son similares a los del laboratorio de virología, y deben emplearse buenas prácticas de laboratorio.
- Realice la manipulación primaria de las muestras en un gabinete de seguridad biológica para evitar los aerosoles y la contaminación del laboratorio.
- Los ácidos nucleicos extraídos pueden ser estériles o no. Un procedimiento de extracción realizado inadecuadamente puede no eliminar o inactivar por completo los agentes infecciosos de la muestra. Se sospecha que el genoma de los virus de ARN de sentido positivo (poliovirus) es infeccioso, y una vez que se introduce en la célula, el genoma viral no requiere ninguna proteína codificada por virus ni componentes adicionales para la replicación viral. Si bien los riesgos de infección por esa vía son muy bajos, es prudente manipular los ácidos nucleicos virales extraídos como si fueran infecciosos. Esta práctica refleja los procedimientos de manipulación de muestras usados en otras áreas del laboratorio y respalda una política unificada de manipulación de muestras para todo el laboratorio.
9. Laboratorio de química
Todas las muestras de origen humano y animal analizadas en el laboratorio de química, toxicología o análisis de fármacos pueden contener agentes infecciosos. Es fundamental comprender y minimizar el riesgo de exposición a las muestras de pacientes mediante el contacto con superficies, la aerosolización o las lesiones penetrantes. La mitigación del riesgo de infecciones adquiridas en el laboratorio se analiza en las Secciones 2 y 3.
9.1. Analizadores automáticos (consulte también 3.17.3 y 10.6.3)
Los analizadores automáticos suelen tener características agregadas que ayudan a reducir las exposiciones de los operadores, pero no eliminan totalmente el potencial de exposición. Una característica común de los sistemas más nuevos es un sistema cerrado de obtención de muestras.
- Los analizadores de química/toxicología suelen tener brazos robóticos de alta velocidad y muestreadores que pueden provocar punciones y laceraciones en la piel. Opere los analizadores únicamente con la tapa cerrada.
- Las sondas de muestras que se mueven o administran líquidos rápidamente pueden generar aerosoles y gotas.
- Use siempre los instrumentos siguiendo las instrucciones del fabricante.
- Asegúrese de que los protectores de seguridad de los instrumentos y dispositivos de contención estén en su lugar en el momento de usarlos.
— Limite la cantidad de movimientos de las manos cerca de la sonda de muestras y los sensores de nivel de líquido.
— Al usar instrumentos en los que el operador debe limpiar las sondas de muestras después de la obtención de las muestras, use guantes y paños de gasa con recubrimiento de plástico impermeable de un lado. Los instrumentos más nuevos tienen ciclos de limpieza automática de las sondas, lo que elimina esta fuente de exposición. - Para prevenir derrames, manipule las bandejas con muestras y las muestras con cuidado, y manténgalas tapadas cuando no las esté manipulando.
- Suponga que el exterior de los tubos de sangre está contaminado y esté listo para limpiar el exterior del tubo con desinfectante para laboratorio o con una solución 1:10 de lejía doméstica.
- Llene los pocillos para muestras y los tubos para alícuotas con dispositivos mecánicos (p. ej., pipetas de transferencia) y nunca los decante (vierta).
- Suponga que los efluentes de los analizadores clínicos están contaminados con patógenos; algunos también pueden estar contaminados con sustancias químicas peligrosas. Su desecho debe cumplir con las reglamentaciones estatales y locales. Investigue esos efluentes y consulte los estándares aplicables antes de verterlos en el desagüe.
- Siga las instrucciones del fabricante para la limpieza de rutina y resolución de problemas ante derrames de muestras sobre los instrumentos o en su interior, incluido el equipo de protección personal (PPE) apropiado y el tipo de solución de limpieza que se debe usar.
— Cuando las instrucciones del fabricante no incluyan instrucciones para la contención y limpieza de derrames, colabore con el fabricante para crear un procedimiento operativo estándar (SOP) que proteja eficazmente al operador y mantenga y extienda la vida útil del instrumento.
— Tenga una solución 1:10 de lejía doméstica a mano en caso de emergencia por un derrame o rotura una vez que el fabricante le haya indicado que el cloro no dañará los componentes de los instrumentos. - Realice una limpieza diaria de los sistemas fluídicos y del muestreador siguiendo las instrucciones del fabricante.
- Recopile los residuos en un recipiente para residuos que contenga una solución recién preparada de lejía doméstica concentrada en cantidad suficiente para lograr una concentración final de lejía al 10 % con el recipiente lleno. No recopile los efluentes que contengan compuestos no compatibles con lejía (Tabla 11) en la lejía, a fin de evitar la formación de gas de cloro.
- No mezcle el hipoclorito de sodio (lejía) con ninguna otra sustancia química a menos que se cuente con los controles de ingeniería y el PPE adecuados. La mezcla accidental puede crear condiciones peligrosas que podrían provocar lesiones al personal y/o dañar la propiedad o el medio ambiente.
9.2. Preparación de tejidos para análisis químico/toxicológico
- Considere todos los tejidos no fijados como biopeligrosos, independientemente del diagnóstico del paciente o de los análisis solicitados.
- El uso de un fijador no siempre es suficiente para eliminar todos los tipos de peligros biológicos.
- Use un gabinete de seguridad biológica (BSC) o PPE, que incluya bata y guantes, con un dispositivo de contención fijo para la aspiración de muestras.
- Los sistemas automáticos de carga de muestras reducen la manipulación de muestras y también procesan las muestras con vórtice en un espacio cerrado que evita la exposición del operador a aerosoles y salpicaduras.
— Tenga especial cuidado al cargar muestras en los soportes para tubos del instrumento.
— En el caso de muestras no fijadas, cargue los soportes para tubos del instrumento dentro de un BSC o use PPE para protegerse de salpicaduras y aerosoles.
9.3. Riesgos de analizadores específicos
Para evaluar adecuadamente el riesgo de peligros biológicos activos en los efluentes o procesos de los analizadores, el análisis de riesgo debe comenzar con la evaluación de los procedimientos que tienen lugar antes del uso de analizadores específicos. Los protocolos de preparación de muestras pueden inactivar por completo virus y bacterias de modo que el riesgo de generación de aerosoles biopeligrosos en el efluente del analizador es, básicamente, cero. Un ejemplo es el uso de técnicas de precipitación de proteínas o de solventes desnaturalizadores de proteínas en la cromatografía de líquidos, lo cual anularía las preocupaciones por peligros biológicos en aerosoles o efluentes generados por el analizador.
9.3.1. Hornos de grafito
- Seque las muestras por completo antes de la vaporización.
- Ventile adecuadamente los dispositivos que empleen calor para vaporizar muestras, a fin de asegurarse de que no se liberen agentes infecciosos al aire ambiente.
- Mantenga las tapas y paneles de los instrumentos cerradas y seguras mientras los instrumentos están en uso de acuerdo con las recomendaciones del fabricante.
9.3.2. Espectrómetros de masas
- Cuando se utilizan espectrómetros de masas como dispositivos de detección que están programados para supervisar los iones seleccionados del efluente de la cromatografía de líquidos (liquid chromatography mass spectrometer, LC-MS), se podría producir una exposición a agentes infecciosos en el efluente si una evaluación de riesgos antes del proceso del analizador muestra que los procedimientos para la preparación de las muestras no inactivan los agentes infecciosos.
- Los dispositivos que utilizan técnicas no destructivas (blandas) para ionizar muestras, p. ej., ionización por pulverización sónica, pueden implicar un riesgo de exposición para los operadores si la evaluación de riesgos previa al proceso del analizador muestra que los procedimientos para la preparación de las muestras no inactivan los agentes infecciosos.
10. Laboratorio de hematología y flebotomía
10.1. Recepción de muestras y estación de registro/preparación
Las pautas de bioseguridad para el laboratorio de hematología son las mismas que para el laboratorio de microbiología, y se describen en la Sección 3.1.
10.2. Trabajo en una mesa abierta
Consulte la sección 3.2.1.
10.2.1. Procedimientos operativos estándares
Los procedimientos operativos estándares se describen en la Sección 3.1.4.
10.2.2. Retiro manual de tapas herméticas y obtención de alícuotas de las muestras/transferencia con pipetas
Consulte la sección 3.1.5.
10.2.3. Muestras no fijadas
- Microscopios
— Desinfecte la platina, los oculares, las perillas y cualquier otra parte contaminada todos los días.
— Elija un desinfectante que no sea corrosivo para el microscopio y que sea apropiado para posibles agentes infecciosos. - Preparaciones de los portaobjetos
— Evite sacudir los portaobjetos en el aire o usar ventiladores eléctricos en una mesa abierta para secar los portaobjetos al aire.
— Se puede usar un ventilador eléctrico para secar portaobjetos en una campana de extracción de gases y, solamente si es necesario, en un gabinete de seguridad biológica (BSC), no sobre la superficie de la mesa. El uso de un ventilador en un BSC alterará el flujo de aire y hará que el BSC no sea adecuado para realizar otros trabajos de laboratorio hasta que se haya estabilizado el flujo de aire. - Frotis de capa leucocitaria
Use tubos desechables Wintrobe en lugar de tubos capilares para evitar cortar tubos de vidrio y la posible exposición a la sangre y a fragmentos de vidrio. - Hemacitómetro
Se recomienda precaución extrema al usar hemacitómetros de vidrio y cubreobjetos de vidrio para evitar punciones con fragmentos de vidrio. Existen hemacitómetros de plástico disponibles comercialmente que ofrecen mediciones y análisis repetibles y confiables. Varios diseños de hemacitómetros eliminan el uso de cubreobjetos y permiten un control exacto del volumen. - Tiempos de sangrado (195)
— Use guantes (consulte las Secciones 3.2.2 y 8.4.2).
— Use los dispositivos de seguridad para plantillas adecuados para pacientes pediátricos/adultos.
— Asegúrese de que los dispositivos se revisen anualmente, en cumplimiento con los Estándares para patógenos transmitidos por la sangre de la Administración de Seguridad y Salud Ocupacionales (OSHA) (33) y las pautas de los CDC (196).
— Use navajas desechables cuando deba eliminar vello del brazo del sitio de análisis.
— Deseche el dispositivo para medir el tiempo de sangrado y la navaja en un recipiente para objetos cortopunzantes, y el papel de filtro en un recipiente para residuos médicos. - Aspirados de médula ósea
— Incluya las políticas y procedimientos adecuados del hospital para el control de infecciones para las áreas de atención a pacientes en la política y los procedimientos del laboratorio para la recolección de aspirados de médula ósea si se obtienen en esas áreas.
— Limite el equipo que se lleva a las habitaciones de los pacientes. Varios fabricantes comercializan kits de bandejas de seguridad para médula ósea. Se recomienda el uso de trefina y agujas de aspiración desechables.
— Recolecte las muestras y prepare los frotis por aplastamiento y los portaobjetos en el laboratorio.
— Si se deben preparar frotis fuera del laboratorio, p. ej., en áreas de atención a pacientes, aplique las precauciones estándares; use una evaluación de riesgos y peligros para determinar qué equipo de protección personal (PPE) puede ser apropiado y cuándo se necesitaría equipo adicional; use una superficie plana y fija para preparar los frotis y los portaobjetos; asegúrese de que las tapas/cubiertas de las muestras adicionales estén cerradas herméticamente antes de su transporte y asegúrese de que los portaobjetos, frotis por aplastamiento y muestras adicionales se transporten en receptáculos a prueba de fugas y resistentes a roturas. - Documente la capacitación y evalúe la competencia del personal del laboratorio. Incluya en la evaluación el conocimiento y cumplimiento de las políticas/procedimientos de control de infecciones del hospital en las áreas de atención a pacientes, y el concepto de las precauciones estándares en todas las capacitaciones documentadas y evaluaciones de competencia.
10.3. Precauciones personales
Las pautas para precauciones personales, incluido el uso de un BSC (Sección 3.3), PPE (Sección 3.2.1) y desinfección (Sección 3.4) se describen en la Sección 3.
10.4. Descontaminación y desecho de residuos de laboratorio (39)
Consulte la Sección 3.5 para ver las pautas de descontaminación y desecho de residuos de laboratorio.
10.5. Áreas sucias en comparación con áreas limpias del laboratorio
Consulte la Sección 3,16.
10.6. Instrumentación
Ya sea que sean automáticos o manuales, los procedimientos que tienen el potencial de producir aerosoles y gotitas de muestras (p. ej., al retirar tapones, procesar con vórtice, abrir o perforar tubos evacuados, dispensadores automáticos de muestras) requieren el uso de PPE o controles de ingeniería diseñados para evitar la exposición a agentes infecciosos.
10.6.1. Baños de agua
Consulte la sección 3.17.1.
10.6.2. Centrífugas
Consulte la sección 3.17.2.
10.6.3. Analizadores automáticos de hematología/hemostasia
Los analizadores automáticos suelen tener características adicionales que ayudan a reducir las exposiciones de los operadores, pero no eliminan totalmente el potencial de exposición. Una característica común de los sistemas más nuevos es un sistema cerrado de obtención de muestras. Consulte las Secciones 3.17.3, 9.1 y 11.6.3 para obtener información adicional.
- Las sondas de muestras que se mueven o administran líquidos rápidamente pueden generar aerosoles y gotitas.
- Use siempre los instrumentos siguiendo las instrucciones del fabricante.
- Asegúrese de que los protectores de seguridad de los instrumentos y dispositivos de contención estén en su lugar en el momento de usarlos.
- Limite la cantidad de movimientos de las manos cerca de la sonda de muestras y los sensores de nivel de líquido.
- Use guantes y paños de gasa con recubrimiento de plástico impermeable de un lado de los instrumentos al usar instrumentos en los que el operador debe limpiar las sondas de muestras después de la obtención de las muestras. Los instrumentos más nuevos tienen ciclos de limpieza automática de las sondas, lo que elimina esta fuente de exposición.
- Manipule las bandejas de muestras y placas de muestras con precaución y cúbralas cuando no se estén obteniendo muestras a fin de evitar derrames.
- Llene los pocillos para muestras y los tubos para alícuotas con dispositivos mecánicos, nunca los decante (vierta).
- Suponga que los efluentes de los analizadores clínicos están contaminados y deséchelos de conformidad con las reglamentaciones ambientales federales, estatales y locales aplicables.
- Siga las instrucciones del fabricante para la limpieza de rutina y resolución de problemas ante derrames de muestras sobre los instrumentos o en su interior, incluido el PPE apropiado y el tipo de solución de limpieza que se debe usar.
- Cuando las instrucciones del fabricante no incluyan instrucciones para la contención y limpieza de derrames, colabore con el fabricante para crear un procedimiento operativo estándar que proteja eficazmente al operador y mantenga y amplíe la vida útil del instrumento.
10.6.4 Citómetros de flujo (consulte la Sección 3.17.3)
La exposición ocupacional en un laboratorio de citometría de flujo (flow cytometry, FCM) de rutina surge por la manipulación de las muestras o, más específicamente, de los aerosoles y gotitas generados por el flujo mismo. Las aplicaciones de la citometría de flujo, p. ej., análisis fenotípico, evaluaciones de flujo de calcio y mediciones de apoptosis de células no fijadas, cuando se realizan con citómetros de flujo de chorro de aire con configuraciones de presión extremadamente alta, pueden exponer a los operadores a aerosoles potencialmente peligrosos.
- Los procedimientos de bioseguridad para FCM se deben enfocar específicamente en la contención de aerosoles, la gestión de residuos y el mantenimiento de los equipos (197).
- Considere todos los materiales no fijados (leucocitos de sangre periférica, médula ósea, fluidos corporales diversos, células cultivadas y muestras ambientales) como biopeligrosos.
— El uso de un fijador no siempre es suficiente para eliminar todos los tipos de peligros biológicos.
— Use un BSC o PPE con un dispositivo de contención fijo equivalente para la aspiración de muestras.
— Use siempre guantes desechables y ropa protectora al operar un citómetro de flujo.
— Permita solamente a los operadores con capacitación y experiencia documentadas (el consenso profesional es 2 años) realizar separaciones celulares potencialmente biopeligrosas (51).
— Restrinja el acceso permitiendo únicamente la presencia de personal esencial durante la separación. Coloque un cartel en la entrada indicando que se está llevando a cabo una separación celular. El personal que desee supervisar la separación debe usar el mismo PPE que el operador del separador celular. - Los separadores celulares están equipados con una boquilla que forma un chorro de microgotas; en este paso es probable que se generen aerosoles.
- Los defectos en los instrumentos, como obstrucción de la boquilla del separador o aire en el sistema fluídico, pueden aumentar drásticamente la formación de aerosoles.
- Se han puesto a la venta accesorios de seguridad de diseño reciente para los separadores celulares. Algunos citómetros de flujo con sistema cerrado de líquidos realizan la separación celular con un mecanismo de intercambio de líquidos. Esos citómetros, a diferencia de los separadores celulares de chorro de aire, no generan aerosoles durante la separación celular.
- La eficiencia de las medidas de control de aerosoles en los instrumentos de separación se debe evaluar periódicamente siguiendo las instrucciones del fabricante, especialmente cuando se adquieren o se separan células humanas no fijadas y muestras biopeligrosas comprobadas.
- Se ha desarrollado una tecnología más simple a base de esferas para medir la eficiencia.
- Los citómetros de flujo más recientes han agregado características de bioseguridad (p. ej., celdas de flujo cerrado, módulos para la contención de gotitas y muestreadores automáticos) para reducir el riesgo de exposición de los operadores a gotitas y aerosoles de muestras generados por los instrumentos.
- Asegúrese de que el instrumento se use de la manera especificada por el fabricante.
- Abra y cierre la tapa del instrumento con cuidado.
- Mantenga las tapas y los paneles del instrumento cerrados y asegurados mientras el instrumento está en uso.
- No desactive las trabas y/o los sensores de seguridad.
- Coloque los tubos de muestras firmemente asegurados en el puerto de introducción de muestras. De lo contrario, podrían explotar al presurizarse y salpicar la muestra sobre el operador.
— Algunos puertos para muestras contienen un tubo de metal para aspiración que puede dañar los guantes cuando el tubo no se inserta con cuidado.
— Para proteger mejor contra las salpicaduras, se recomienda el uso de gafas de seguridad o gafas contra salpicaduras de sustancias químicas durante la adquisición.
— Los sistemas automáticos de carga de muestras reducen la manipulación de las muestras y también procesan las muestras con vórtice en un espacio cerrado que evita la exposición del operador a aerosoles y salpicaduras. Tenga especial cuidado al cargar muestras en los soportes para tubos del instrumento con estos sistemas. En el caso de muestras no fijadas, cargue los soportes para tubos del instrumento dentro de un BSC o use PPE para protegerse de salpicaduras y aerosoles. - Realice una limpieza diaria de los sistemas fluídicos y del muestreador siguiendo las instrucciones del fabricante.
- Recopile los residuos en un recipiente para residuos que contenga una solución recién preparada de lejía doméstica concentrada en cantidad suficiente para lograr una concentración final del 10 % cuando el recipiente esté lleno.
Nota: Agregar cloro a un recipiente de residuos en el que se usa un tampón de cloruro de amonio Tris como agente lisante puede liberar gas de cloro peligroso. En su lugar, utilice un yodóforo de amplio espectro.
10.6.5. Dispositivos automáticos para tinción de portaobjetos
- Asegúrese de que el instrumento se use de la manera especificada por el fabricante.
- Mantenga las tapas y los paneles del instrumento cerrados y asegurados mientras el instrumento está en uso.
10.6.6. Sistemas de análisis hematológico totalmente automáticos o semiautomáticos
- Realice evaluaciones de peligros o riesgos para identificar las operaciones fundamentales que representan un riesgo de exposición.
- Los procedimientos operativos estándares deben incluir:
— instrucciones para la resolución de problemas ante rotura de los tubos y derrame de muestras en cintas transportadoras, correas, separador, alícuota y estaciones de sondas de perforación de tapas;
— instrucciones que requieran como mínimo limpieza y desinfección diarias y limpieza después de la rotura de un tubo y/o derrames de muestras; y
— PPE apropiado que se debe usar al limpiar y resolver problemas de piezas robóticas.
Nota: Los filtros HEPA o la cinta adhesiva enrollada sostenida con fórceps son útiles para retirar partículas finas de vidrio. - Si el fabricante no proporciona instrucciones, colabore con él para crear procedimientos de resolución de problemas y limpieza que protejan al operador, y que sean compatibles y extiendan la vida útil del equipo robótico.
10.7. Análisis rápidos (kits) (Sección 3.18)
Considere que los kits de análisis usados están contaminados y deséchelos adecuadamente de conformidad con las reglamentaciones ambientales locales y estatales aplicables.
10.8. Análisis molecular (198)
- El Instituto de Estándares Clínicos y de Laboratorio publicó estándares para los ensayos de amplificación de ácidos nucleicos en hematopatología (199).
- Se debe respetar estrictamente el flujo de trabajo unidireccional y la separación espacial de las áreas de trabajo además de las pautas de seguridad de laboratorio estándares para las operaciones en la mesa y con los instrumentos.
— La preparación de reactivos es el área más limpia, luego viene el área de preparación de muestras y, por último, el área de detección de productos.
— Deje los objetos transportables, p. ej., plumas, cinta adhesiva, tijeras, cajas de guantes, en cada área designada (consulte la Sección 3.19). Codificar cada área por colores y usar cinta adhesiva para codificación por colores y batas de laboratorio codificadas por colores ayuda a reforzar la separación espacial de las áreas de trabajo y a mantener los objetos transportables en sus áreas designadas.
— Cámbiese la bata y los guantes de laboratorio y lávese las manos antes de entrar a cada área (consulte la Sección 3.19).
10.9. Flebotomía
- Evalúe, seleccione y utilice dispositivos de ingeniería para prevención de lesiones con objetos cortopunzantes que sean aceptables para la atención clínica y brinden una protección óptima contra lesiones. En la evaluación de los dispositivos de ingeniería para prevención de lesiones con objetos cortopunzantes y la consideración de su uso prospectivo deben participar los empleados que utilizan objetos cortopunzantes.
- Establezca un proceso para brindar una evaluación anual y selección de dispositivos para prevención de lesiones con objetos cortopunzantes (196; Sección 3.14).
10.9.1. Recomendaciones generales (200–203)
- Asegúrese de que se pueda acceder fácilmente a los recipientes para desechar objetos cortopunzantes en las habitaciones de los pacientes y en las áreas de extracción de sangre para pacientes; estos nunca deben estar más de tres cuartos llenos y se deben incluir en la evaluación anual, selección y uso de dispositivos para prevención de lesiones con objetos cortopunzantes (204).
- Asegúrese del cumplimiento estricto de todas las políticas y procedimientos aplicables para la atención de pacientes y el control de infecciones en las áreas de extracción para pacientes.
- Lávese las manos con jabón común y agua o con una solución antimicrobiana para protegerse de la exposición externa e interna a patógenos transmitidos por la sangre. Asegúrese de lavarse las manos antes de colocarse los guantes; después de quitarse los guantes; después del contacto con cada paciente o muestra de un paciente; antes de salir del laboratorio, de la estación de extracciones o de la habitación de un pacientes; antes de comer y después de haber tocado con las manos una superficie posiblemente contaminada.
- Establezca un proceso y procedimiento para el transporte de muestras dentro de las instalaciones y, si corresponde, fuera de las mismas (93).
— Si las muestras de un paciente se van a transportar de la estación de extracción a otra área del centro, asegúrese de que se transporten en un recipiente secundario que tenga una tapa con seguro bien ajustada y que esté hecho de un material que pueda contener la sangre si se derrama.
— El manual de procedimientos del servicio de mantenimiento de flebotomía debe incluir instrucciones para la respuesta ante derrames y limpieza de derrames de todas las áreas del hospital con potencial para derrame de muestra (incluidas las áreas como elevadores y huecos de escaleras).
— Asegúrese de que los servicios de mensajería empleados por el laboratorio implementen la política del laboratorio para el transporte de muestras y asegúrese de que exista documentación de la capacitación del personal y evaluación de competencia sobre el transporte de muestras (incluidos los procedimientos de respuesta ante un derrame, limpieza e informe de incidentes).
10.9.2. Áreas limpias en comparación con áreas sucias del laboratorio
Consulte la sección 3.16.
10.9.3. Sistemas de tubos neumáticos
Consulte la sección 3.1.6.
10.9.4. Precauciones personales
Consulte la sección 3.2.
10.9.5 Desinfección del espacio de trabajo
Consulte la sección 3.4.1.
Independientemente del método, el propósito de la descontaminación es proteger al técnico de flebotomía, al paciente y al medioambiente, y a cualquiera que ingrese a la habitación de un paciente/estación de extracciones o que manipule materiales que hayan entrado o salido de la habitación de un paciente/estación de extracciones.
- Limite los materiales de flebotomía que se llevan a la habitación de un paciente.
- Limpie en forma rutinaria las superficies ambientales antes de preparar el área de trabajo de la habitación de un paciente/estación de extracciones, y vuelva a limpiarlas antes de salir de la habitación de un paciente o después de cada paciente en el área de trabajo de la estación de extracciones.
- Desinfecte cualquier objeto (p. ej., pluma, teléfono) que haya tocado con guantes.
- No use alcoholes ni soluciones a base de alcohol para desinfectar áreas de superficie porque estos se evaporan rápidamente, lo cual disminuye en gran medida su eficacia. En su lugar, utilice desinfectantes acuosos, como una dilución 1:10 de lejía doméstica o el desinfectante recomendado por el hospital.
- Use desinfectantes recomendados para superficies ambientales, como una dilución 1:10 de lejía doméstica u otros desinfectantes registrados en la EPA que sean eficaces contra el virus de la hepatitis B, el virus de la inmunodeficiencia humana y otros patógenos transmitidos por la sangre (205).
10.9.6. Desinfección de las áreas de trabajo de las habitaciones de pacientes y las estaciones de extracciones
Consulte la sección 3.4.1.
- Incluya instrucciones en el manual de procedimientos que se refieran a qué tipo de PPE se debe usar, cómo limpiar, qué desinfectante usar y cómo desechar los materiales. Coloque las instrucciones en el consultorio de flebotomía para consultarlas fácilmente.
- Deje la sangre o fluidos corporales secos en contacto con el desinfectante contra la tuberculosis durante al menos 20 minutos para permitir su penetración y fácil eliminación.
- Nunca use un cuchillo u otro instrumento para rasquetear la sangre o fluidos corporales secos de áreas de superficie ya que eso puede generar aerosoles.
10.9.7. Documentación de la capacitación y evaluación de la competencia en flebotomía
La evaluación incluye el conocimiento y cumplimiento de cualquier política/procedimiento de control de infecciones del hospital aplicable en las áreas de atención a pacientes y el concepto de las precauciones estándares.
11. Banco de sangre
11.1. Enfermedades transmitidas por transfusiones
Muchos agentes infecciosos se transmiten por la transfusión de sangre infectada; estos incluyen el virus de la hepatitis B, el virus de la hepatitis C, los virus de inmunodeficiencia humana 1 y 2, los virus linfotrópicos de células T humanos (human T-cell lymphotropic viruses, HTLV-I y II), citomegalovirus, parvovirus B19, virus del Nilo occidental, virus del dengue, tripanosomiasis, malaria y variantes de la enfermedad de Creutzfeldt-Jakob. La AABB también proporciona información sobre enfermedades transmitidas por transfusiones, que está disponible en http://www.aabb.org/Pages/Homepage.aspx.
11.2. Estándar sobre patógenos transmitidos por la sangre
El Estándar sobre patógenos transmitidos por la sangre de la Administración de Seguridad y Salud Ocupacionales (OSHA), 29 CFR 1910.1030, se debe cumplir en el laboratorio de un banco de sangre (33).
11.3. Recepción de muestras y estación de registro/preparación
Las pautas para la recepción y registro de muestras y la manipulación de recipientes con muestras se describen en la Sección 3.1.
11.4. Trabajo en una mesa abierta
Los procedimientos escritos para un banco de sangre incluyen prácticas laborales específicas y controles de prácticas laborales para mitigar las posibles exposiciones. Los procedimientos operativos estándares (SOP) y los manuales de procedimientos se describen en la Sección 3.1.4.
11.4.1. Muestras no fijadas
- Microscopios
— Desinfecte la platina, oculares, brazos y cualquier otra parte contaminada después de usar o según un cronograma específico determinado por el laboratorio.
— Elija un desinfectante apropiado que no sea corrosivo para el microscopio (consulte la Sección 3.4.1). - Preparaciones de los portaobjetos
— reemplace los objetos de vidrio con objetos de plástico cuando sea posible.
— Evite sacudir los portaobjetos en el aire o usar ventiladores eléctricos en una mesa abierta para secar los portaobjetos al aire.
— Si se usan otros instrumentos para secar los portaobjetos, realice una evaluación de riesgos para medir el riesgo de generación de aerosoles. - Lavado manual de células
Realice una evaluación de riesgos/peligros.
— Para el lavado de suspensiones celulares con solución salina, el uso de lavadoras automáticas de células reduce algunos de los peligros asociados con este procedimiento, pero no todos.
— Verter lavados con solución salina en recipientes para decantación puede generar salpicaduras y aerosoles. Las salpicaduras se pueden minimizar con el uso de pipetas semiautomáticas y manteniendo los niveles de líquidos de los recipientes para decantación por debajo de un cuarto de su capacidad. Use protectores fijos o equipo de protección personal (PPE) impermeable apropiado para protegerse de salpicaduras.
— Al agitar pequeños tubos con muestras para volver a suspender pastillas de glóbulos rojos y leer la aglutinación final, use protectores de mesa fijos o el PPE apropiado para protegerse de salpicaduras y pulverizaciones. - Realice los procedimientos con un extractor de plasma o un expresor con protección facial y ocular apropiada para protegerse de pulverizaciones y de la posible explosión de las bolsas de sangre/componentes.
- Use protección facial y ocular apropiada al cortar segmentos de donante durante el análisis de confirmación u otros análisis.
- Limpie las superficies externas de las bolsas de sangre y los componentes con una toalla humedecida con un desinfectante apropiado antes de liberar para infusión, y asegúrese de que el desinfectante no comprometa la bolsa de plástico.
- Si se han implementado controles de ingeniería para evitar salpicaduras o pulverizaciones en las mesas de trabajo de un banco de sangre, se puede modificar el requisito del PPE según una evaluación y la evidencia de la eficacia del control de ingeniería para evitar la exposición a salpicaduras o pulverizaciones.
11.4.2. Gabinete de seguridad biológica
Se requiere un gabinete de seguridad biológica (BSC; consulte la Sección 3.3) clase III para todos los procesos que generen aerosoles.
11.4.3. Equipo de protección personal
Consulte la sección 3.2.2.
11.4.4. Desinfección
Consulte la sección 3.4.
11.4.5. Descontaminación y desecho de residuos de laboratorio
Consulte la sección 3.5 para ver un análisis, que incluye un plan de gestión de residuos.
11.5. Áreas limpias en comparación con áreas sucias del laboratorio
Consulte la sección 3.16.
11.6. Instrumentación
Consulte la sección 3.17.
11.6.1. Refrigeradores y congeladores
En todos los refrigeradores y congeladores del banco de sangre, establezca un protocolo de limpieza y mantenimiento que minimice la contaminación y extienda la vida útil del equipo y que, a la vez, mantenga los complejos sistemas de enfriamiento que necesitan los refrigeradores de los bancos de sangre para brindar una recuperación de la temperatura rápida y uniforme cuando sea necesario. (consulte también la Sección 3) La mayoría de los refrigeradores y congeladores más nuevos para bancos de sangre son de acero inoxidable y tienen acabado de pintura y bandejas extraíbles, lo cual facilita el proceso de limpieza y desinfección.
- Las instrucciones del fabricante para el uso y el cuidado de los refrigeradores y congeladores de bancos de sangre por lo general incluyen el PPE y el tipo de desinfectante recomendados.
- Colabore con el fabricante para establecer los SOP para la limpieza y el mantenimiento si el equipo no viene con instrucciones.
- Limpie inmediatamente los derrames de sangre.
- Limpie las manijas y las puertas exteriores alrededor de las manijas del refrigerador al final de cada turno.
- Rotule el refrigerador con el símbolo universal de peligro biológico y las palabras “Peligro biológico”.
11.6.2. Analizadores automáticos de bancos de sangre
Ahora existen instrumentos automáticos o semiautomáticos que se adaptan a la recolección de sangre de donantes o a las transfusiones a pacientes. Si bien esos instrumentos tienen el potencial para reemplazar gran parte de los análisis realizados en la mesa abierta en los bancos de sangre y en la recolección de sangre de donantes, todavía se usa el análisis manual para la detección de anticuerpos y procesos de verificación y en laboratorios más pequeños. Todos los analizadores automáticos de bancos de sangre cuyo uso está aprobado actualmente en Estados Unidos tienen características agregadas que ayudan a reducir las exposiciones de los operadores, pero no han eliminado totalmente el potencial de exposición.
- Las sondas de muestras que se mueven o administran líquidos rápidamente pueden generar aerosoles y gotas.
- Asegúrese de que los instrumentos se usen según las instrucciones del fabricante.
- Asegúrese de que los protectores de seguridad de los instrumentos y dispositivos de contención estén en su lugar en el momento de usarlos.
- Limite la cantidad de movimientos de las manos cerca de las sondas de muestras y los sensores de nivel de líquido.
- Use guantes y paños de gasa con recubrimiento de plástico impermeable de un lado de los instrumentos al usar instrumentos en los que el operador debe limpiar las sondas de muestras.
- Manipule las bandejas de muestras, tarjetas de muestras y placas de muestras con precaución y cúbralas cuando no se estén obteniendo muestras a fin de evitar derrames.
- Llene los tubos para alícuotas con dispositivos mecánicos, nunca los decante (vierta).
- Considere los efluentes de los analizadores clínicos como contaminados y deséchelos de conformidad con las reglamentaciones estatales y locales.
- Siga las instrucciones del fabricante para la limpieza de rutina y resolución de problemas ante derrames de muestras sobre los instrumentos o en su interior, incluido el PPE apropiado y el tipo de solución de limpieza que se debe usar.
- Cuando las instrucciones del fabricante no incluyan instrucciones para la contención y limpieza de derrames, colabore con el fabricante del instrumento para crear un SOP que proteja eficazmente al operador y mantenga y extienda la vida útil del instrumento.
11.6.3. Sistemas de análisis totalmente automáticos o semiautomáticos
Consulte la sección 10.6.6.
11.7. Kits para análisis y bandejas de reactivos
Consulte la sección 10.7.
11.8. Recolección de sangre de donantes, aféresis y desecho
Las áreas de recolección de sangre de donantes y aféresis se consideran áreas de atención a pacientes y se deben respetar estrictamente todas las políticas/procedimientos aplicables de atención de pacientes y control de infecciones del hospital.
- Establezca y mantenga procesos y procedimientos para controlar la calidad del análisis de enfermedades infecciosas y el desecho y transporte seguros de toda la sangre y hemoderivados recolectados.
- Use las precauciones estándares.
- Aplique evaluaciones de riesgos y peligros para determinar qué PPE adicional puede ser apropiado y cuándo.
- Asegúrese de que las cubiertas/tapas de cualquier muestra adicional estén bien cerradas antes de transportarlas.
- Coloque la sangre o hemoderivados que se transportarán desde el sitio de recolección a otro lugar en un recipiente secundario que, además de mantener un rango de temperatura especificado, también tenga una tapa hermética y esté hecho de un material que pueda contener derrames de sangre.
- Coloque las unidades de donante único o componentes que se usarán para transfusión dentro de un recipiente secundario que pueda contener derrames, en especial cuando las condiciones ambientales podrían provocar una ruptura (p. ej., sistemas de tubos neumáticos).
- Seleccione y utilice dispositivos de ingeniería para prevención de lesiones con objetos cortopunzantes que sean aceptables para la atención clínica y brinden una protección óptima contra lesiones. Consulte la Sección 3.14.1 para ver un análisis de la prevención de punciones y cortes.
- Establezca un proceso para brindar una evaluación anual del uso y la selección de dispositivos para prevención de lesiones con objetos cortopunzantes (196).
- Procure un fácil acceso a los recipientes para desechar objetos cortopunzantes; nunca los llene más de tres cuartos e inclúyalos en la evaluación anual, selección y uso de dispositivos para la prevención de lesiones con objetos cortopunzantes.
- No guarde la sangre de donante y los componentes con las muestras de pacientes y bandejas de reactivos.
- Documente la capacitación y evalúe la competencia del personal del laboratorio. Incluya en la evaluación el conocimiento y cumplimiento de las políticas/procedimientos de control de infecciones del hospital en las áreas de atención a pacientes y el concepto de las precauciones estándares en todas las capacitaciones documentadas.
- Deseche la sangre, componentes sanguíneos y tejidos vencidos de conformidad con las reglamentaciones federales, estatales y locales.
12. Laboratorio de diagnóstico veterinario
12.1. Introducción
En esta sección se proporcionan pautas útiles para las prácticas laborales que minimizan los peligros de bioseguridad derivados de muestras para diagnóstico veterinario. Muchas de las pautas de prácticas de bioseguridad de los laboratorios de microbiología clínica humana se aplican en los laboratorios de diagnóstico veterinario. De forma similar a lo que sucede en los laboratorios de microbiología clínica humana, la naturaleza del trabajo realizado en los laboratorios de diagnóstico veterinario también pone a estos empleados de laboratorio en riesgo de contraer infecciones adquiridas en el laboratorio. El 60 % de las enfermedades infecciosas en humanos se deben a patógenos de múltiples huéspedes que atraviesan las líneas de especies (206,207), y durante los últimos 30 años, el 75 % de las enfermedades emergentes por patógenos humanos (p. ej., virus de la fiebre del Nilo occidental, gripe aviar extremadamente patogénica, enfermedad de Lyme) fueron zoonóticas, es decir, transmitidas entre humanos y animales (208). Todas las muestras no humanas para diagnóstico son potencialmente infecciosas para los humanos, aunque el grado de riesgo es menor que al manipular y examinar muestras humanas para diagnóstico. Los posibles agentes infecciosos en muestras humanas para diagnóstico son, por definición, patógenos humanos. Por el contrario, no todos los posibles agentes infecciosos en las muestras animales para diagnóstico son patógenos humanos. La clave para gestionar el riesgo de bioseguridad en los laboratorios de diagnóstico veterinario depende no solamente de buenas prácticas generales de bioseguridad, sino también, y de forma aun más importante, de una evaluación de riesgos práctica con respecto a la muestra para diagnóstico “desconocida”.
En general, en los laboratorios de diagnóstico veterinario se usan prácticas e instalaciones con un nivel de bioseguridad (BSL)-2 para el trabajo de diagnóstico veterinario general, y se realiza una evaluación de riesgo práctica de los registros entrantes para determinar si se requieren prácticas de bioseguridad o instalaciones con nivel menor (BSL-1) o uno mayor (BSL-3). En esta sección se destacan las diferencias entre el riesgo y las prácticas de bioseguridad en la manipulación de muestras para diagnóstico en humanos y animales.
12.2. Clasificación y evaluación del riesgo biológico
12.2.1. Clasificación del riesgo
Se han elaborado dos grupos de clasificación de riesgos para facilitar la evaluación de riesgo de diversos microbios y para recomendar prácticas de seguridad apropiadas para la manipulación de esos microbios (1). La Organización Mundial de Sanidad Animal (World Organization for Animal Health, OIE) y la Organización Mundial de la Salud (World Health Organization, WHO) mencionan cuatro grupos de agentes biopeligrosos para los humanos y los animales en función del nivel de riesgo y la existencia de tratamiento y prevención eficaces (Tabla 12) (209). Las pautas de los CDC/Institutos Nacionales de Salud (CDC/NIH) proponen cuatro niveles de bioseguridad y recomendaciones para prácticas de contención adecuadas para agentes que han demostrado provocar infecciones adquiridas en el laboratorio (Tablas 12,13) (1). Las dos listas de grupos de riesgo son más o menos equivalentes y en ninguna se considera a las personas que son especialmente susceptibles a infecciones debido a afecciones preexistentes, como un sistema inmunológico comprometido o embarazo. En ambos sistemas de clasificación de grupos de riesgo, el aumento de los niveles de riesgo (números) implica un aumento del riesgo ocupacional por la exposición a un agente y la necesidad de contención adicional para trabajar con ese agente.
- En general, en el trabajo de rutina de los laboratorios de diagnóstico veterinario se supone que las muestras clínicas contienen agentes del grupo 2 y se trabaja con prácticas BSL-2 a menos que una evaluación de riesgos indique otra cosa. Ocasionalmente, en los laboratorios de diagnóstico veterinario podrían encontrarse agentes del grupo 3 y usar prácticas BSL-3. Solo en circunstancias extraordinarias las muestras para diagnóstico veterinario contendrían agentes del grupo de riesgo 4; estos no se incluyen aquí. Se enumeran ejemplos de agentes de los grupos de riesgo 2 y 3 que se encuentran comúnmente en laboratorios de diagnóstico veterinario (Recuadro 2).
- Además de agentes zoonóticos, los laboratorios de diagnóstico veterinario deben evaluar la sospecha de la presencia de “patógenos de ganado con consecuencias mayores” durante la evaluación de riesgos. Los patógenos de ganado con consecuencias mayores son definidos por el programa de Agentes agrícolas seleccionados del Servicio de Inspección de Salud Animal y Vegetal (Animal and Plant Health Inspection Service, APHIS) del Departamento de Agricultura de EE. UU. (U.S. Department of Agriculture, USDA), de acuerdo con las reglamentaciones sobre agentes y toxinas seleccionados publicadas en 2008 en el Registro Federal de EE. UU. por el Departamento de Salud y Servicios Humanos de EE. UU. (U.S. Department of Health and Human Services) (42 CFS parte 73) y el USDA (9 CFS parte 121, y 7 CFS parte 331) (40). Los criterios usados para clasificar los patógenos de ganado con consecuencias mayores incluyen la gravedad del efecto en los productos animales, la virulencia y la transmisibilidad del agente y la existencia de un tratamiento eficaz. Aunque no son necesariamente agentes zoonóticos, los patógenos de ganado con consecuencias mayores pueden tener un grave efecto perjudicial en materia económica en la salud en los animales de granja, y para su manipulación se requieren prácticas e instalaciones BSL-3 para evitar la dispersión y la contaminación ambientales (Recuadro 3).
12.2.2. Evaluación del riesgo
Consulte la Sección 2 para ver pautas detalladas sobre la evaluación de riesgos.
- No hay un abordaje o método estándar oficial o una manera correcta de realizar una evaluación de riesgos, pero existen varias estrategias, como el uso de una matriz de establecimiento de prioridades de riesgos, realizar un análisis de peligros laborales o simplemente enumerar los posibles escenarios de lo que podría salir mal durante un procedimiento, tarea o actividad. En la evaluación de riesgos en los laboratorios de diagnóstico veterinario, se tiene en cuenta la probabilidad de que diversos microorganismos de grupos de riesgo o BSL estén presentes en muestras clínicas desconocidas, además de la probabilidad de que el procesamiento de rutina de las muestras clínicas exponga a los trabajadores de laboratorio a agentes infecciosos presentes en esas muestras. En una evaluación de riesgos se tendrá en cuenta la fuente de la muestra clínica (lo que incluye especies huéspedes y antecedentes clínicos), el patógeno sospechado dentro de una muestra con las características inherentes de su grupo de riesgo, la actividad laboral durante el análisis de diagnóstico de la muestra clínica en el laboratorio y las competencias y experiencia del personal del laboratorio.
- Las evaluaciones de riesgos más importantes para los laboratorios de diagnóstico veterinario son la consideración de las especies huéspedes, la afección médica conocida y los antecedentes clínicos del paciente, los signos clínicos del paciente y las condiciones geográficas endémicas locales. (En muchos laboratorios reciben muestras de áreas geográficas vastas y diversas.)
- Ciertos agentes del grupo de riesgo 3 son endémicos de regiones geográficas específicas o de especies y síndromes clínicos específicos y requerirían aumentar las prácticas BSL a niveles apropiados. Algunos ejemplos son la tularemia, que provoca muerte súbita en la ardilla gris occidental en el oeste de Estados Unidos, el ántrax, que provoca muerte súbita en el ganado en la región central norte de Estados Unidos, Coxiella burnetii, que provoca abortos bovinos, y psitacosis, que provoca enfermedad respiratoria o entérica en aves de pajarería. De manera alternativa, una evaluación de riesgos podría indicar una reducción de las prácticas de bioseguridad con respecto a las prácticas BSL-2 de rutina. Un ejemplo serían las muestras de sangre animal enviadas para análisis serológico. A diferencia de las muestras de sangre humana, que pueden albergar patógenos humanos transmitidos por la sangre, como el virus de la inmunodeficiencia humana o el virus de la hepatitis, el suero animal generalmente no contiene patógenos zoonóticos transmitidos por la sangre, y a menudo se podría manipular con prácticas BSL-1 en función de una evaluación de riesgos.
- La evaluación de los antecedentes clínicos y otros datos proporcionados en un formulario de registro/envío al laboratorio depende del criterio profesional y debe ser realizada o supervisada por un veterinario calificado que conozca los agentes zoonóticos y seleccionados (Recuadros 2,3) y las enfermedades que provocan esos agentes. Si surgen preguntas durante el registro y anotación del caso que no se pueden aclarar con la documentación del registro, comuníquese por teléfono con el veterinario que envió la muestra. Es fundamental conocer los signos clínicos típicos, el rango de los huéspedes, la epidemiología básica y la distribución geográfica de las enfermedades provocadas por esos agentes.
- La evaluación de riesgos de bioseguridad en las muestras para diagnóstico veterinario es fundamental porque el potencial patogénico para los humanos en las muestras para diagnóstico veterinario es diferente del de las muestras humanas.
12.3. Pautas generales de bioseguridad
Consulte la Sección 3 para ver pautas de bioseguridad exhaustivas y detalladas que, en general, se aplican a todas las áreas de subdisciplinas de un laboratorio de diagnóstico veterinario.
- La persona con mayor riesgo de exposición y de contraer una infección adquirida en el laboratorio es el empleado de laboratorio que trabaja en la identificación de un agente infeccioso del que se sospecha dentro de la muestra para diagnóstico; por lo tanto, la elección de prácticas laborales de laboratorio para evitar la exposición personal es una de las decisiones más importantes al diseñar el plan de bioseguridad de un laboratorio.
- En el laboratorio, las vías de exposición son limitadas e incluyen la inhalación de aerosoles infecciosos de gotas finas transportados por el aire, el contacto directo con la piel o las membranas mucosas o la ingestión de material infeccioso de gotas grandes o la transmisión percutánea por agujas u otros objetos cortopunzantes (Tabla 1). El Comité de Sustancias Biológicas Peligrosas en el Laboratorio del Consejo Nacional de Investigación (National Research Council Committee on Hazardous Biological Substances in the Laboratory) recomendó en 1989 siete prácticas básicas prudentes de bioseguridad para evitar la exposición a agentes infecciosos a través de las vías más comunes de infección en el laboratorio (210). Esas prácticas, si bien están identificadas como las más importantes, se deben complementar con prácticas adicionales, equipos y diseño de las instalaciones siempre que haya un aumento en el riesgo de exposición a un peligro de bioseguridad o la posibilidad de exposición a un agente BSL-3.
12.3.1. Lavado de manos
- El lavado de manos es el procedimiento más importante para reducir la duración de la exposición a un agente infeccioso y evitar la diseminación del agente infeccioso. La contaminación de las manos se produce durante la manipulación de la muestra y el contacto con superficies de trabajo, teléfonos y equipo.
- El personal de laboratorio se debe lavar las manos
— inmediatamente después de quitarse los guantes;
— después de contaminación evidente;
— después de terminar un trabajo;
— antes de irse del laboratorio y
— antes de tocar con las manos piel no intacta, ojos o membranas mucosas.
12.3.2. Equipo de protección personal
- Para el trabajo de rutina en los laboratorios de diagnóstico veterinario y clínicos, debe proporcionarse equipo de protección personal (PPE) y este debe usarse y mantenerse en el espacio de trabajo del laboratorio. Capacite a los empleados del laboratorio en el uso de PPE para tareas específicas y para que conozcan las limitaciones del PPE y los procedimientos apropiados para mantener y desechar el PPE. El nivel de uso de PPE en el trabajo de rutina del laboratorio de diagnóstico veterinario debe ser suficiente para las prácticas BSL apropiadas para el riesgo sospechado o identificado y, como mínimo, debe incluir guantes y ropa protectora.
- Los guantes protegen a la persona que los usa de la exposición a material potencialmente infeccioso y suelen ser guantes delgados de látex, vinilo o nitrilo. Deben cambiarse con frecuencia. La ropa protectora incluye delantales o batas de mangas largas que se puedan cerrar por completo y que se extiendan por debajo del nivel de la mesa de trabajo. No se debe usar calzado abierto en el laboratorio para evitar derrames accidentales en la piel expuesta. No use ropa protectora fuera del laboratorio ni se la lleve a casa para limpiarla o lavarla.
- Use protección facial y ocular cuando puedan generarse salpicaduras o pulverizaciones de material potencialmente infeccioso durante el procesamiento en el laboratorio, lo cual incluye la limpieza del laboratorio. El equipo de protección para la cara y los ojos puede incluir gafas contra salpicaduras, protectores faciales o protectores de mesa contra salpicaduras.
- Use dispositivos de protección respiratoria (mascarillas) si la evaluación de riesgos indica prácticas BSL adecuadas para evitar la inhalación de aerosoles potencialmente infecciosos. La decisión de usar mascarillas en el laboratorio puede derivar del riesgo inherente de posibles agentes infecciosos en una muestra clínica (p. ej., agentes BSL-3 o del grupo de riesgo 3) o de las manipulaciones necesarias en el laboratorio para la identificación de un agente, que podrían producir aerosoles infecciosos. El tipo de protección respiratoria depende del peligro específico. Si no puede usarse una mascarilla N95 o superior (p. ej., debido a vello facial o asma) use una mascarilla purificadora de aire automática (PAPR) cuando se requiera protección respiratoria. Las mascarillas quirúrgicas no constituyen una protección respiratoria eficaz.
12.3.3. Capacitación del personal
- La capacitación en materia de bioseguridad y la educación de los trabajadores acerca de los peligros potenciales y las prácticas laborales seguras son fundamentales para crear un ambiente laboral seguro. El alcance del programa de capacitación en seguridad variará según las necesidades, pero debe incluir:
— precauciones estándares;
— selección, uso y limitaciones del PPE;
— gestión de residuos biopeligrosos;
— gestión posterior a la exposición, informe e investigación de incidentes;
— información sobre patógenos transmitidos por la sangre;
— comprensión básica de los grupos de riesgo y la evaluación de riesgos y
— procedimientos para los derrames biopeligrosos. - Documente la capacitación en bioseguridad (fecha y contenido de la capacitación) en el registro de capacitación de los empleados y conserve el registro durante 3 años. Evalúe periódicamente la eficacia de la capacitación de seguridad en el laboratorio. Las evaluaciones de seguridad podrían incluir auditorías de seguridad, inspecciones realizadas por organismos externos, revisión de informes de incidentes y observaciones y sugerencias de los empleados. Si bien la gerencia proporciona los recursos para abordar y corregir las deficiencias de seguridad, los esfuerzos del personal de laboratorio que trabaja en las mesas aportan los cimientos para un ambiente laboral seguro.
12.3.4. Manejo de derrame biológico
- El manejo de derrames biológicos en los laboratorios clínicos debe tener en cuenta el agente infeccioso específico (si se conoce), el volumen del material infeccioso derramado y la presencia de aerosoles. Los aerosoles pueden transmitir fácilmente derrames con agentes BSL-3 o del grupo de riesgo 3. Por tanto, los ocupantes deben evacuar las áreas de inmediato, cerrar las puertas y no volver a ingresar al área durante 30 a 60 minutos.
- El PPE para derrames biológicos incluye guantes resistentes a punciones, mascarillas N95 (BSL-2 o 3), protectores de calzado, batas o delantales impermeables y protección facial.
- Con agentes BSL-3, use una mascarilla o una mascarilla con filtro HEPA. Otra opción es llamar a un equipo de respuesta ante derrames designado. Retire cualquier vidrio roto del área del derrame y deséchelo sin tocarlo con las manos (use [p. ej.,] una escoba, fórceps, pinzas). Un procedimiento típico de limpieza de un derrame biológico que implica la posible presencia de un aerosol debe incluir lo siguiente:
— Alertar al personal del área y evacuar.
— Cerrar las puertas y no volver a ingresar al área durante 30 a 60 minutos (colocar un cartel que prohíba el ingreso al área) según la cantidad de intercambios de aire.
— Alertar al supervisor del laboratorio.
— Colocarse el PPE apropiado para el tipo de derrame.
— Sacar y desechar vidrios rotos u otros objetos (sin tocarlos con las manos).
— Absorber el derrame con material absorbente.
— Desechar el material contaminado en un recipiente para residuos biopeligrosos.
— Limpiar el derrame con un detergente acuoso.
— Descontaminar el área con un desinfectante apropiado.
— Enjuagar el sitio del derrame con agua y dejar secar.
— Copiar los formularios de laboratorio contaminados y desechar en el recipiente para residuos biopeligrosos.
— Colocar todo el material de limpieza desechable contaminado en la bolsa para residuos biopeligrosos y tratar como residuos infecciosos.
— Lavarse las manos.
— Preparar un informe de derrame/incidente, identificar la causa del derrame y determinar las acciones de corrección. - Si se produce un derrame en un gabinete de seguridad biológica (BSC), no apague el ventilador del gabinete. Los derrames menores en un BSC se pueden absorber con papel absorbente. Si el material infeccioso fluye hacia la rejilla, limpie todos los objetos del gabinete con desinfectante y retírelos. Cierre la válvula de drenaje y vierta desinfectante en la superficie y por la rejilla hacia la bandeja de drenaje. Deje en contacto el tiempo apropiado, luego drene, enjuague y seque.
- Cuando se produzca una rotura en una centrífuga (lo cual, inherentemente, produciría aerosoles), mantenga la centrífuga cerrada herméticamente durante 30 minutos antes de iniciar la descontaminación.
- Si se rompe un tubo con una muestra dentro del bote de plástico con tapa a rosca de una centrífuga:
— Apague el motor.
— Retire el bote inmediatamente y colóquelo en un BSC.
— Notifique a la persona de más rango a cargo y a otros colegas que trabajen en el área.
— Con la ropa protectora colocada, abra el bote en el gabinete de seguridad biológica.
— Vierta una dilución 1:10 de lejía o un desinfectante no corrosivo en el bote para descontaminar todas las superficies. Deje el bote sumergido en la solución de lejía o desinfectante durante 10 minutos. Limpie el bote exhaustivamente.
— No levante vidrios rotos con las manos con guantes. Use fórceps o algodón sostenido con un fórceps, o pinzas o hemostatos y deséchelos en un recipiente de bioseguridad para objetos cortopunzantes
— Deseche todos los materiales no cortopunzantes contaminados del bote en una bolsa roja para residuos de peligro biológico a fin de desecharlos con los residuos de peligro biológico.
— Pase un hisopo con el mismo desinfectante por los tubos tapados que no se hayan roto, luego vuelva a pasar el hisopo, lávelos con agua y déjelos secar.
— Trate todos los materiales usados durante la limpieza como residuos infecciosos.
Nota: Si los tubos para muestras se rompen en una centrífuga que no tiene botes individuales pero tiene una tapa de protección contra peligros biológicos y un rotor sellado, siga las instrucciones del fabricante para la limpieza y la descontaminación.
12.3.5. Vacunación
- El Comité Asesor sobre Prácticas de Inmunización, además de recomendar la inmunización del personal de atención médica con las vacunas recomendadas para todos los adultos (antigripal, sarampión/paperas/rubeola, varicela y tétanos/difteria/tos ferina), recomienda la vacuna antimeningocócica o contra la hepatitis B para las personas con riesgo por exposición ocupacional (211). Esos agentes no están presentes en las muestras para diagnóstico veterinario. En los laboratorios de diagnóstico veterinario, no se recomienda la inmunización de rutina del personal del laboratorio contra posibles patógenos del grupo de riesgo 3 o BSL-3. La única situación en la que debe considerarse la inmunización es contra la rabia en el caso de empleados que procesen una gran cantidad de muestras que puedan contener el virus de la rabia (p. ej., procesamiento de rutina de tejidos del sistema nervioso central de animales con enfermedad neurológica compatible con la rabia) (Tabla 14) (212).
12.4. Patología (necropsia y patología quirúrgica)
Consulte la Sección 5 para ver pautas detalladas de bioseguridad aplicables las áreas de trabajo de necropsia, patología quirúrgica e histología de un laboratorio de diagnóstico veterinario.
12.5. Parasitología
Consulte la sección 6.
12.6. Micología
Consulte la sección 7.
12.7. Virología
Consulte la sección 8.
12.8. Toxicología
Consulte la sección 9.
12.9. Hematología/Serología
Consulte la sección 10.
12.10. Diagnóstico molecular y análisis rápidos
Las pautas de bioseguridad que se deben seguir al realizar un análisis para diagnóstico molecular (es decir, reacción en cadena de la polimerasa [PCR]) o al usar análisis rápidos como el ensayo de inmunoabsorbción enzimática (ELISA) pueden ser específicas para el análisis específico que se está realizando. Estas se analizan en la Sección 3 y las Secciones 4, 5, 6, 7, 8 y 10, que abordan tipos específicos de patógenos y su análisis. En la Sección 8.10 se encuentran las pautas de bioseguridad más completas para el análisis para diagnóstico molecular.
12.11. Almacenamiento, empaque y envío
Consulte la Sección 13 para ver pautas de bioseguridad detalladas aplicables a las funciones de un laboratorio de diagnóstico veterinario en lo que respecta al almacenamiento, el empaque y el envío de muestras infecciosas o para diagnóstico.
12.12. Educación/capacitación en bioseguridad
Consulte la Sección 15 para ver pautas prácticas con respecto a la capacitación en bioseguridad un laboratorio de diagnóstico veterinario.
12.13. Mejora de la calidad en bioseguridad
Consulte la Sección 16 para ver pautas sobre la mejora continua en bioseguridad en un laboratorio de diagnóstico veterinario.
13. Almacenamiento, empaque y envío de sustancias infecciosas
13.1. Almacenamiento de sustancias infecciosas
En un laboratorio de microbiología clínica, las sustancias infecciosas se encuentran en muestras frescas y procesadas de pacientes, cultivos y subcultivos, aislados almacenados y suero o plasma. Invariablemente, todas esas sustancias deben ser almacenadas cada tanto de alguna forma y durante cierto tiempo, y muchas de esas sustancias serán manipuladas, reubicadas y tocadas en otras situaciones por el personal del laboratorio. Por lo tanto, el almacenamiento de sustancias infecciosas es un componente importante e integral de la seguridad de los trabajadores en los laboratorios de microbiología clínica. Manipule todas las sustancias infecciosas almacenadas usando las precauciones estándares y una técnica aséptica. Los organismos responsables de la contaminación externa del vial de almacenamiento seguirán siendo viables durante el almacenamiento y se pueden transmitir al manipular el vial.
- Use recipientes primarios con tapas herméticas.
- Almacénelos lo más lejos posible de las vías de paso comunes, carros de laboratorio, tránsito de personas y reactivos.
- Asegúrese de que el sitio de almacenamiento tenga acceso restringido.
- Asegúrese de que las temperaturas de almacenamiento sean las apropiadas para mantener la viabilidad de los microorganismos.
- Use soportes, cubetas o cajas sólidos que garanticen que el objeto se mantenga en posición vertical.
- Procure usar gabinetes o refrigeradores de almacenamiento con puertas con trabas.
- Use refrigeradores diferentes para almacenar a largo plazo archivos de cultivos, subcultivos y muestras de pacientes procesadas.
13.2. Empaque y envío de sustancias infecciosas
- El uso de laboratorios de referencia para análisis de rutina y análisis especializados ha aumentado en los últimos años. Algunos laboratorios de referencia tal vez no puedan enviar un servicio de mensajería para recoger las muestras del laboratorio que las envía. Por lo tanto, conocer los estándares para el transporte de muestras y los requisitos necesarios para enviar muestras usando transportistas aéreos y terrestres comunes se ha vuelto cada vez más importante para los laboratorios de diagnóstico.
- La Sociedad Estadounidense de Microbiología ha publicado pautas exhaustivas para empaquetar y enviar sustancias infecciosas (213-215). Estas se basan en las pautas elaboradas por la Asociación Internacional de Transporte Aéreo (International Air Transport Association, IATA) y el Departamento de Transporte (DOT) de EE. UU. La información que se presenta aquí es una versión abreviada de esas pautas y no tiene por fin ser una guía exhaustiva para el empaque y envío de sustancias infecciosas. Es posible que se necesiten permisos además de estos requisitos.
Nota: Los requisitos y reglamentaciones que rigen el transporte de sustancias infecciosas cambian frecuentemente. Los remitentes tienen la responsabilidad de conocer estos cambios, respetar las reglamentaciones actuales, obtener los permisos antes del envío e interpretar las reglamentaciones aplicables pare ellos mismos y sus instalaciones. Se recomienda a las personas que envían estas sustancias revisar los sitios web de los organismos correspondientes respectivos.
13.2.1. Autoridades reguladoras y reglamentaciones
- Las pautas para empaque y envío más reconocidas y utilizadas del mundo son las de la publicación anual de la IATA Reglamentaciones sobre productos peligrosos (Dangerous Goods Regulations) (216).
- En Estados Unidos, el DOT regula el transporte comercial de productos peligrosos (p. ej., explosivos, gases, líquidos inflamables, sustancias infecciosas y materiales radiactivos) realizado por transportistas aéreos y terrestres (93). Las reglamentaciones del DOT coinciden considerablemente con la IATA.
13.2.2. Importancia de las reglamentaciones
El propósito de las reglamentaciones es proteger al público, al personal de respuesta a emergencias, a los empleados de laboratorios y al personal de la industria del transporte de la exposición accidental al contenido infeccioso de los paquetes. Un beneficio importante no relacionado con la seguridad que trae aparejado el respeto de esas reglamentaciones y requisitos es minimizar el potencial de daño del contenido del paquete durante el transporte y reducir la exposición del remitente a asumir responsabilidades penales y civiles por el envío incorrecto de productos peligrosos.
13.2.3. Excepciones
- El transporte de pequeñas cantidades de sustancias infecciosas que no pertenecen a la categoría A (por lo general, muestras que se transportan con fines clínicos, de diagnóstico o para otro tipo de atención al paciente; consulte la Sección 13.3) está exento de la mayoría de las reglamentaciones del DOT si las muestras las transporta un servicio de mensajería, es decir, un transportista privado o contratado con un vehículo automotor utilizado exclusivamente para transportar esas sustancias (93).
- Empaque y asegure en el vehículo las sustancias infecciosas que no pertenecen a la categoría A según las reglamentaciones del DOT.
- Esas reglamentaciones del DOT suelen ser menos estrictas que las reglamentaciones de la Administración de Seguridad y Salud Ocupacionales (OSHA), y establecen que las sustancias solamente se deben transportar en recipientes a prueba de fugas, cerrados herméticamente y bien asegurados dentro del vehículo durante el transporte. Las reglamentaciones habituales de la OSHA siguen en vigencia durante el transporte de sustancias infecciosas por servicio de mensajería. Visite los sitios web del DOT y la IATA para ver las actualizaciones.
13.2.4. Reglamentaciones específicas
- El transporte seguro y legal de las sustancias infecciosas se basa en las siguientes actividades obligatorias:
— capacitación cada 2 (IATA) o 3 (DOT) años para las personas que manipulan sustancias infecciosas para su envío;
— clasificación y designación de las sustancias infecciosas;
— selección de los materiales de empaque correctos;
— empaque correcto de los envíos;
— colocación de marcas y rótulos adecuados en el embalaje externo y
— documentación de los aspectos relevantes de cada paquete y su contenido.
13.2.5. Servicio Postal de EE. UU.
El Servicio Postal de EE. UU. (U.S. Postal Service, USPS) publica sus propias reglamentaciones en el Manual de correo nacional (Domestic Mail Manual) del USPS (96). Las reglamentaciones del USPS para el envío de materiales peligrosos en general adhieren a las reglamentaciones del DOT; no obstante, consulte el Manual de correo nacional del USPS para ver necesidades y requisitos específicos.
13.3. Clasificación de las sustancias infecciosas
13.3.1. Clasificación
Todos los productos enviados deben clasificarse mediante un proceso de tres pasos para definir cuáles son los productos peligrosos enviados por transportistas comerciales. La clasificación permite al remitente seleccionar las instrucciones de empaque y las instrucciones de uso adecuadas de la IATA, y aporta la información necesaria para completar la documentación requerida (una Declaración del remitente sobre productos peligrosos) si la sustancia es una sustancia infecciosa que pertenece a la categoría A.
13.3.2. Pasos de la clasificación
- El material se clasifica en una de las nueve clases especificadas por la IATA (clase 1 a clase 9) de productos peligrosos. Las sustancias infecciosas y tóxicas son productos peligrosos clase 6; el hielo seco es un producto peligroso clase 9. Las sustancias clase 6 y clase 9 son, por lo general, los únicos productos peligrosos que envía el personal de laboratorio.
- Las sustancias clase 6 se deben categorizar en la división 6.1 (sustancias tóxicas) o en la división 6.2 (sustancias infecciosas).
- Las sustancias infecciosas de la división 6.2 deben clasificarse en uno de los nueve tipos especificados por la IATA de sustancias infecciosas: sustancia infecciosa de categoría A, sustancia infecciosa de categoría B, muestras de pacientes, muestras humanas o animales exentas, organismos modificados genéticamente, sustancias exentas, productos biológicos, animales infectados o residuos médicos (Tabla 15).
- Si se determina que la sustancia es una “muestra de paciente” o un “organismo” y no es evidente que sea una sustancia de categoría A o categoría B, pero cumple los criterios o tiene características de una sustancia de categoría A o categoría B, el remitente debe clasificarla como una sustancia de categoría A o categoría B. De lo contrario, la sustancia se debe clasificar como “muestra humana o animal exenta” u “organismo modificado genéticamente” (clase 9), respectivamente.
13.3.3. Sustancias infecciosas de la categoría A
Una sustancia categoría A es “una sustancia infecciosa que se transporta en una forma que, en caso de producirse una exposición, es capaz de provocar discapacidad permanente, una enfermedad potencialmente mortal o una enfermedad mortal a los humanos o animales por lo demás sanos” (93).
- Las sustancias categoría A están designadas y enumeradas específicamente por la IATA y el DOT. La lista de sustancias categoría A no es exhaustiva; la IATA le permite al remitente realizar una evaluación minuciosa del riesgo y aplicar el criterio y el juicio profesional al decidir si una sustancia cumple los criterios de la categoría A. A las sustancias de la categoría A se les debe asignar un número de UN, UN2814 o UN2900 (Figura 2).
Nota: Ciertas sustancias infecciosas de la categoría A solo se consideran de categoría A si la sustancia está en forma de cultivo, es decir, concentrada; esta distinción está claramente indicada en la lista específica de la IATA. - Ciertos patógenos de la categoría A fueron designados como agentes de bioterrorismo y se conocen como agentes seleccionados (40). Las reglamentaciones federales exigen a los remitentes un registro especial y autorización para poseer, usar, transferir y recibir agentes seleccionados.
13.3.4. Sustancias infecciosas de la categoría B
Una sustancia de la categoría B es “una sustancia infecciosa que no cumple los criterios para la inclusión en la categoría A” (93). Las sustancias de la categoría B no están en una forma que, en general, sea capaz de provocar discapacidad, una enfermedad potencialmente mortal o una enfermedad mortal. A las sustancias de la categoría B se les debe asignar un número de UN, UN3373 (sustancia biológica, categoría B). A continuación se presentan ejemplos de posibles sustancias de categoría B:
- Muestras clínicas, para diagnóstico o de pacientes típicas, p. ej., sangre, biopsias, muestras en hisopos, excreciones, secreciones, fluidos corporales o tejidos (a) enviados para realizar cultivos o análisis de detección de rutina de uno o más microorganismos infecciosos que no pertenecen a la categoría A, o (b) de los que se sospecha que contienen uno o más microorganismos que no pertenecen a la categoría A;
- Cultivos típicos de laboratorio clínico (por lo general en medios sólidos o líquidos) de microorganismos que no pertenecen a la categoría A y se encuentran y manipulan habitualmente en laboratorios de microbiología clínica (Figura 2).
13.3.5. Muestras humanas (o animales) exentas
Las muestras de partes corporales humanas o animales exentas son aquellas que presentan una “mínima probabilidad de que haya patógenos presentes” (93). Algunos ejemplos de esas muestras incluyen orina o suero para análisis de glucosa, colesterol, niveles hormonales, antígeno prostático específico y analitos usados para evaluar la función cardíaca y renal.
- El criterio profesional y el conocimiento de los antecedentes médicos del paciente se pueden usar para determinar si la muestra presenta riesgo infeccioso o contiene patógenos.
- Las muestras humanas o animales exentas tienen requisitos de empaque menos estrictos que las sustancias de la categoría A o B. La IATA exige que los empaques externos que contengan muestras humanas o animales exentas estén rotulados claramente como “Muestra humana exenta” o “Muestra animal exenta”. El DOT no exige ese rótulo en los embalajes externos (Figura 2).
13.3.6. Sustancias exentas
Muchas sustancias que se encuentran comúnmente en los laboratorios clínicos están exentas de los estrictos requisitos para el envío de sustancias infecciosas (Figura 2). Algunos ejemplos de dichas sustancias son
- Sustancias que no contienen sustancias infecciosas o es poco probable que provoquen enfermedad en humanos y animales;
- La mayoría de las muestras ambientales (p. ej., comida, suelo);
- Sustancias que contienen microorganismos neutralizados o inactivados;
- Sustancias para análisis de detección de alcohol o fármacos, indicadores de embarazo, cáncer y anticuerpos;
- Muestras enviadas para análisis forense;
- Manchas de sangre seca y muestras para detección de sangre oculta en las heces;
- Sangre y componentes sanguíneos recolectados para transfusión o trasplante;
- Productos biológicos aprobados y autorizados por la Administración de Drogas y Alimentos (FDA) y
- < 30 ml de formalina al 10 % por recipiente primario cuando se usa formalina como conservante.
13.3.7. Muestras de pacientes
- Una “muestra de paciente” es material recolectado directamente de humanos o animales con fines de diagnóstico, tratamiento, prevención, experimentales o de investigación.
- Las muestras de pacientes que cumplen los criterios de la categoría A o la categoría B deben clasificarse como sustancias de categoría A o categoría B.
- Las muestras de pacientes que no cumplen criterios de la categoría A ni de la categoría B deben tratarse como muestras humanas o animales exentas (Figura 2).
13.3.8. Organismos modificados genéticamente
Los organismos modificados genéticamente suelen cumplir los criterios de la categoría A o de la categoría B. Si no es así, el organismo se debe clasificar como un “microorganismo modificado genéticamente” (clase 9, Productos peligrosos diversos) y se debe empacar y enviar como tal.
13.3.9. Productos biológicos
Prácticamente todos los productos biológicos disponibles para la venta están exentos de las reglamentaciones para el empaque y envío de sustancias infecciosas. Algunos ejemplos de productos biológicos incluyen sueros para tipificación bacteriana, vacunas, antígenos bacterianos, agentes antimicrobianos, reactivos para identificación de bacterias y reactivos usados en análisis de susceptibilidad antimicrobiana.
13.3.10. Animal infectado
- Un animal vivo infectado intencionalmente, que tiene o razonablemente podría tener una sustancia infecciosa no puede ser transportado por aire a menos que la sustancia no pueda transportarse por ningún otro medio. Se necesitará una exención del DOT.
- Se recomienda consultar con cada transportista comercial si es necesario enviar un animal infectado, ya sea que esté vivo o muerto.
13.3.11. Residuos médicos
- Los residuos médicos que contienen sustancias infecciosas de la categoría A o la categoría B se deben empacar y enviar como tales, y se les debe asignar un número UN2814, UN2900 o UN3373.
- Los residuos médicos de los que se crea razonablemente que tienen una baja probabilidad de contener sustancias infecciosas se deben empacar y enviar como “residuos médicos no especificados de otra manera” (not otherwise specified, n.o.s) (UN3291).
13.4. Designación de las sustancias de la categoría A o la categoría B
- Después de clasificar la sustancia, el remitente debe identificar (designar oficialmente) las sustancias infecciosas de categoría A o categoría B, asignando a la sustancia uno de los > 3.000 números de UN especificados por la IATA y reconocidos a nivel internacional junto con los nombres de envío correctos enumerados en la sección de las páginas azules de las Reglamentaciones sobre productos peligrosos de la IATA (216).
- Esta lista aporta 14 puntos informativos para cada uno de los nombres propios de envío; los puntos corresponden a la información necesaria para completar la Declaración del remitente sobre productos peligrosos. Afortunadamente, solo siete de los 3.000 nombres propios de envío se emplean en la mayoría de los laboratorios de microbiología clínica:
— Dos para sustancias de la categoría A que afectan a los humanos;
— Dos para sustancias infecciosas de la categoría A que afectan a los animales;
— Uno para una sustancia infecciosa de la categoría B;
— Uno para organismos modificados genéticamente;
— Uno para hielo seco. - En las páginas azules se encuentran los nombres de envío correctos, los números UN, instrucciones para el empaque, límites de cantidades y otra información relacionada con el empaque y el envío de sustancias.
13.5 Instrucciones de empaque y cómo empacar las sustancias
13.5.1. Instrucciones e indicaciones para el empaque
- Las instrucciones de empaque (packing instructions, PI) de la IATA describen los estándares mínimos para el transporte seguro de sustancias infecciosas.
- Las instrucciones usadas por los laboratorios clínicos son las relacionadas con sustancias infecciosas de la categoría A (PI 620), sustancias infecciosas de la categoría B (PI 650) y hielo seco (PI 954).
- No hay instrucciones específicas numeradas como PI para muestras clasificadas como “muestras humanas o animales exentas”; no obstante, la IATA proporciona indicaciones que se deben respetar (Tabla 16).
13.5.2. Marcado y rotulado de los empaques externos
- Los remitentes son los responsables de marcar y rotular adecuadamente el recipiente de envío externo (por lo general, una caja de cartón).
- Las marcas y rótulos comunican información esencial sobre el remitente y el consignatario del paquete, la naturaleza y el contenido del paquete, el peligro potencial de la sustancia, cómo está empacada la sustancia e información que se debe usar en caso de emergencia (Figuras3,4).
13.5.3. Marcas y rótulos específicos
En la siguiente lista se citan las situaciones en las que se necesita un marcador o rótulo y las marcas o rótulos específicos para esa situación.
- Remitente y consignatario: nombre y dirección del remitente y el consignatario;
- Persona a cargo: nombre y número de teléfono de una persona que puede responder preguntas generales sobre el envío;
- Sustancia de categoría A: rótulo de clase 6 con forma de rombo para “Sustancia infecciosa” y nombre de envío correcto (no el nombre técnico), número de UN y rótulo de cantidad;
- Sustancia de categoría B: rótulos de “Sustancia biológica, categoría B” y “UN3373”;
- Hielo seco: rótulo de clase 9, “Productos peligrosos varios” y peso del hielo seco;
- Orientación del paquete: flechas en lados opuestos de los paquetes que contengan > 50 ml de un líquido o un líquido congelado;
- Muestras de pacientes exentas: rótulo de “Muestra humana exenta” o “Muestra animal exenta”;
- Empaque externo que contiene una sustancia infecciosa de la categoría A: rótulo de “UN”; UN encerrado en un círculo y una serie de letras y números que indiquen el tipo de paquete, la clase de productos que el paquete está diseñado para transportar, la fecha de fabricación, el organismo que lo autoriza y el fabricante.
13.6. Documentación
13.6.1. Declaración del remitente sobre productos peligrosos
- Una Declaración del remitente es un contrato legal entre el remitente y el transportista. En ella se debe documentar el envío de sustancias infecciosas de la categoría A y debe ser precisa y legible.
- Prácticamente toda la información técnica especificada por la IATA necesaria para completar la sección “Naturaleza y cantidad de los productos peligrosos” de la Declaración se puede encontrar en las páginas azules de las Reglamentaciones sobre productos peligrosos de la IATA (216).
13.6.2. Número de teléfono para respuesta a emergencias
- Las reglamentaciones del DOT (aunque no las de la IATA) establecen que debe proporcionarse un número de teléfono para respuesta a emergencias en las declaraciones del remitente que acompañen envíos de sustancias infecciosas de la categoría A.
- El número debe ser supervisado en todo momento por una persona (no un contestador automático, un servicio de mensajes o un buscapersonas) que conozca los peligros del material que se está transportando y la respuesta ante una emergencia, además de información sobre mitigación de incidentes en caso de que una persona que manipula el envío entre en contacto con el contenido liberado del paquete. Ese número también puede pertenecer a un servicio comercial que proporciona la información de mitigación apropiada. Si se utiliza el número de teléfono de un servicio comercial, el número de contrato o número de acuerdo de servicio asignado por el servicio comercial debe ingresarse en el documento, además del nombre del prestador del servicio.
13.6.3. Guías aéreas
Los transportistas de la IATA deben preparar guías aéreas que describan los cargamentos aéreos y acompañen los envíos en tránsito. Algunos envíos de productos peligrosos, como los envíos de sustancias biológicas de la categoría B, requieren la preparación de este documento pero no de una Declaración del remitente. Las instrucciones específicas para la preparación se detallan en cada instrucción de empaque de la IATA y en la sección “Documentación” de las Reglamentaciones sobre productos peligrosos.
13.7. Refrigerantes
El empaque debe ser a prueba de fugas cuando se usa hielo común. El hielo seco es un producto peligroso clase 9; se debe empacar de acuerdo con PI 954 y su uso requiere completar una Declaración del remitente si se emplea para enviar una sustancia de la categoría A.
Nota: El hielo seco constituye un peligro de explosión y nunca debe colocarse en un recipiente cerrado herméticamente. El hielo seco se debe colocar por fuera del segundo recipiente y el empaque externo debe permitir la liberación de CO.
13.8. Capacitación y certificación
- Cualquier persona que participe en el empaque y envío de sustancias infecciosas debe recibir capacitación formal en esta actividad; cada 2 años según la IATA y cada 3 años según el DOT. Los componentes esenciales de un programa de capacitación deben incluir
— conocimientos generales y familiaridad con el empaque y el envío de sustancias infecciosas;
— importancia, naturaleza y contenido de las reglamentaciones de la IATA y el DOT;
— clases prácticas y/o demostraciones de técnicas de empaque y embalaje;
— marcado y rotulado;
— documentación de envíos de productos peligrosos;
— capacitación en seguridad;
— evaluación antes y después de la capacitación y
— entrega de un certificado tras completar satisfactoriamente la capacitación. - Los materiales y métodos de capacitación aceptables incluyen manuales, cursos de capacitación y talleres; todo esto está disponible comercialmente mediante organizaciones profesionales y proveedores comerciales de materiales de empaque para productos peligrosos. Cualquier hospital, laboratorio, escuela, institución u otro centro puede elaborar un programa o taller de capacitación que incluya capacitación didáctica y práctica, así como demostraciones.
- La IATA y el DOT exigen que se documenten todos los aspectos de la capacitación. El documento más importante usado para demostrar una capacitación apropiada y oportuna es un certificado emitido después de completar la capacitación.
— Los empleadores deben llevar un registro de cada empleado que fue capacitado.
— El registro debe incluir el nombre del empleado, el lugar y fecha de la capacitación, nombre del capacitador, contenido del curso, documentación de evaluación y una copia del certificado de capacitación. La certificación de la IATA y el DOT es válida durante 2 y 3 años, respectivamente. - El DOT, a través de la Administración de Seguridad de Oleoductos y Materiales Peligrosos (Pipeline and Hazardous Materials Safety Administration, PHMSA), y la Administración Federal de Aviación (Federal Aviation Administration) tienen la autoridad para realizar inspecciones no anunciadas de laboratorios clínicos cuyos empleados empacan y envían sustancias infecciosas, con el fin de inspeccionar estas instalaciones y determinar si cumplen con las reglamentaciones de capacitación, y para inspeccionar los registros de capacitación de estas instalaciones. Las instalaciones que no cumplan con las reglamentaciones recomendadas están sujetas a multas considerables.
14. Procedimientos ante emergencias y responsabilidades
El riesgo de contraer una infección adquirida en el laboratorio (LAI) después de tener contacto físico con un microorganismo (una “exposición”) en el lugar de trabajo es real, siempre está presente y es una parte integral del trabajo en un laboratorio de diagnóstico y, en especial, en el laboratorio de microbiología clínica. El potencial de exposición existe siempre que en un laboratorio se manipulan y transportan microorganismos, se procesan y almacenan muestras de pacientes y se operan instrumentos usados en el proceso. Los laboratorios de diagnóstico pueden ser lugares seguros para trabajar si las prácticas y procedimientos laborales estándares de seguridad apropiados son de fácil acceso y los empleados los comprenden, los hacen cumplir y los respetan. Esos procedimientos deben estar descritos adecuadamente en un plan de control de exposiciones y manuales de laboratorio. Estos planes están compuestos por elementos esenciales relacionados con cómo evitar la exposición y, lo que es igualmente importante, describen la participación de empleador y empleado, y las responsabilidades antes y después de una exposición. Tomar medidas apropiadas después de una exposición puede reducir en gran medida o incluso eliminar la posibilidad de que una exposición conduzca a una LAI. Los planes bien diseñados, que cuenten con el total apoyo del director y la alta gerencia pueden reducir las posibilidades de exposición a microorganismos de los trabajadores y pueden ayudar a garantizar una cultura de seguridad en los laboratorios de diagnóstico.
14.1. Responsabilidades de los empleadores antes de una exposición
14.1.1. Plan de control de exposiciones
- Los empleadores deben establecer un plan formal que detalle las prácticas y procedimientos laborales para minimizar el potencial de una exposición.
- Los empleadores deben tener un plan formal para abordar las medidas que deben tomarse después de la exposición de un empleado. El plan es incorporar, como mínimo, los elementos que se presentan aquí (o equivalentes) y que estos sean de fácil acceso para los empleados.
- Tanto el empleador como el empleado deben adoptar el plan y participar rigurosamente en su propia protección y la de sus colegas, el personal y los pacientes.
- Elabore el plan antes de que se produzca una primera exposición, con aportaciones del director del laboratorio, los trabajadores del laboratorio y representantes de control de salud e infecciones de los empleados, o un proveedor de servicios médicos de un centro local, para garantizar la inclusión de la inmunización adecuada, profilaxis posterior a la exposición y medidas de control de infecciones.
- Documente la revisión anual de dispositivos médicos más seguros y demás avances en tecnología de investigación que puedan reducir o eliminar posibles riesgos de exposición.
- Desarrolle una “cultura de la seguridad” con el aporte adecuado de todos los niveles de empleados, incluidos la alta gerencia y los trabajadores de primera línea. Elabore una estructura de informe no punitiva para posibles exposiciones ocupacionales y tenga disposiciones implementadas para que los empleados que informen espontáneamente cambios en su salud sean reasignados, si es necesario, sin que eso influya negativamente en su desempeño laboral ni en su revisión de desempeño.
— Asegúrese de que todos los incidentes potenciales se informen independientemente de si el empleado considera que se produjo una exposición. El empleador y el médico ocupacional deben evaluar el incidente para determinar si se necesita profilaxis posterior a la exposición.
— A los consultorios médicos designados para realizar esas evaluaciones médicas se les deben proporcionar las recomendaciones actuales del Servicio de Salud Pública de EE. UU. para evaluaciones médicas y profilaxis posterior a la exposición para los agentes infecciosos en uso.
— Colabore con los proveedores de atención de la salud ocupacional para asegurarse de que estén equipados para evaluar a trabajadores de laboratorio clínico que podrían haber tenido una exposición ocupacional a diversos agentes infecciosos.
14.1.2. Documentación de posibles exposiciones
- Elabore un registro o formulario que incluya la siguiente información:
— Fecha, hora y ubicación de la exposición;
— Nombre del empleado y número de empleado;
— Nombres de otros empleados relacionados con el incidente (p. ej., testigos);
— Detalles del incidente o la exposición; nombres comerciales y fabricante de cualquier dispositivo o instrumento involucrado, incluidos los números de lote de los dispositivos médicos y equipo de protección personal (PPE) usado al momento de la exposición;
— Información médica relevante/estado del empleado expuesto en el momento de la exposición;
— Medidas inmediatas o correctoras tomadas, incluidos primeros auxilios;
— Medidas que se recomienda que el empleado expuesto tome inmediatamente o el mismo día (p. ej., visita al departamento de salud de los empleados o al de emergencias, administración de quimioprofilaxis, consultas con médicos);
— Resultados de las conversaciones con el personal de atención de salud de los empleados;
— Supervisión y planes de seguimiento;
— Espacio para registrar los resultados de la supervisión y los planes de seguimiento;
— Firmas correspondientes (como mínimo, las del empleado y su supervisor inmediato).
14.1.3. Equipos e instalaciones para respuesta a emergencias
- Los empleados deben recibir capacitación sobre el uso correcto de todo el equipo de emergencia.
- Debe haber kits de primeros auxilios a la vista y con fácil acceso dentro del laboratorio. Debe haber rápido acceso a estaciones de lavado de ojos y duchas de seguridad que cumplan con las especificaciones del Instituto Estadounidense de Estándares Nacionales (ANSI) y deben cumplir con los estándares del ANSI y con cualquier estándar de la Administración de Seguridad y Salud Ocupacionales (OSHA) que exija su colocación. Limpiar abrasiones cutáneas, enjuagarse los ojos o ducharse después del contacto con la piel puede reducir en gran medida o incluso eliminar la posibilidad de que una exposición conduzca a una LAI.
- Se debe informar a los empleados y se les debe recordar con frecuencia la importancia y las ubicaciones del equipo y las instalaciones para emergencias. Asegúrese de que se hayan implementado procedimientos para documentar que todo el equipo funciona correctamente (p. ej., estándares del ANSI para lavado de los ojos y duchas) y dentro de fechas aceptables de vencimiento (p. ej., kit de primeros auxilios).
14.1.4. Vacunas
El Comité Asesor sobre Prácticas de Inmunización, además de recomendar la inmunización del personal de atención médica con las vacunas recomendadas para todos los adultos (antigripal, sarampión/paperas/rubeola, varicela y tétanos/difteria/tos ferina), recomienda la vacuna antimeningocócica o contra la hepatitis B para las personas con riesgo por exposición ocupacional (211,217,218).
- Los microbiólogos que habitualmente están expuestos a aislados de Neisseria meningitidis se deben vacunar (217). El personal de laboratorio que manipula aislados de N. meningitidis está entre los grupos con mayor riesgo de contraer enfermedad meningocócica, y se han documentado casos mortales de enfermedad meningocócica adquirida en el laboratorio (218).
- La inmunización de los empleados en general y en estas situaciones en particular se aborda de manera más eficaz en políticas institucionales de salud de los empleados o control de las infecciones. Consulte el sitio web de vacunas de los CDC para ver información y recomendaciones actualizadas sobre inmunizaciones (http://www.cdc.gov/vaccines). Los empleadores deben dar a conocer al personal del laboratorio la existencia y disponibilidad de todas las vacunas.
14.1.5. Educación de los empleados
- Los empleados deben recibir capacitación inicial y repaso de la capacitación por lo menos en forma anual, y se debe documentar esa capacitación. La capacitación deberá cubrir todos los procedimientos de laboratorio necesarios empleados en las instalaciones para reducir el riesgo de exposición. La capacitación incluye la siguiente información:
— Controles de ingeniería implementados (incluido el equipo de seguridad);
— Procedimientos apropiados usados para la manipulación de muestras;
— PPE y procedimientos que deben seguirse en caso de una exposición. - Se debe informar y recordar con frecuencia a los empleados que:
— Muchas medidas apropiadas y razonables adoptadas después de una exposición pueden reducir en gran medida o incluso eliminar la posibilidad de que una exposición conduzca a una LAI.
— Esas medidas se detallan en un plan de manejo de exposiciones.
— Pueden consultar a profesionales de atención de la salud de los empleados y de control de infecciones después de una exposición.
— Cuáles son las inmunizaciones apropiadas para los trabajadores de los laboratorios de microbiología clínica que están disponibles. - También se les debe informar cuáles son los síntomas de las infecciones y los procedimientos de seguimiento.
- Documente que el empleado haya leído y comprendido todos los procedimientos que se adoptaron para respaldar el plan formal de manejo de exposiciones del laboratorio.
14.2. Responsabilidades de los empleados antes de una exposición
Es responsabilidad de los empleados del laboratorio hacer lo siguiente:
- Respetar las precauciones estándares y otras prácticas institucionales de seguridad en el laboratorio en todo momento.
- Nunca realizar procedimientos de laboratorio, manipular microorganismos, procesar muestras de pacientes u operar instrumentos de identificación microbiológica si eso puede aumentar el riesgo de una LAI.
- Saber qué hacer inmediatamente si se produjo una exposición o se sospecha que puedo haber ocurrido.
— Conocer los manuales y procedimientos de control de infecciones del laboratorio y dónde están ubicados.
— Conocer la ubicación de los kits de primeros auxilios, estaciones de lavado de ojos y duchas, y saber cómo usarlos. - Mantener informado al supervisor acerca de su estado de salud (p. ej., inmunocompetencia, cortes, abrasiones, embarazo, problemas respiratorios) a fin de determinar la posibilidad de un aumento del riesgo de LAI mientras se realiza una tarea en particular.
Nota: Se recomienda a los empleados informar cambios en su estado de salud, pero no se les puede obligar a hacerlo. Se debe elaborar e implementar una disposición sobre cómo tratar esta situación. - Conocer los signos y síntomas característicos de cualquier agente infeccioso transmitido por aerosoles que se aísle y manipule habitualmente en el laboratorio. Informar dichos síntomas a los supervisores si se experimentan.
14.3. Responsabilidades de los empleadores después de una exposición
14.3.1. Determinación del alcance de la exposición
- La probabilidad de que una exposición conduzca a una LAI se relaciona directamente con varias variables, entre ellas:
— concentración del microorganismo al que estuvo expuesto el empleado;
— forma física del microorganismo (p. ej., caldo, colonia, liofilizado, aerosol);
— virulencia innata del microorganismo;
— duración de la exposición del trabajador al microorganismo;
— uso correcto del PPE;
— estado de inmunocompetencia del trabajador expuesto; y
— portal de entrada (piel intacta, inflamada, con abrasión o corte; punción con aguja; membrana mucosa; vía respiratoria; vía oral). - Inmediatamente después de cualquier exposición:
— Examinar (junto con el empleado expuesto si es posible) todos los detalles del incidente de exposición.
— Determinar el grado en el que esas variables (y otras si corresponde) estuvieron involucradas en la exposición.
— Tomar una decisión con respecto al grado de exposición.
— Acordar un curso de acción aceptable para evitar o reducir las posibilidades de que el empleado desarrolle una LAI. - Tal vez se necesite hablar con el proveedor de atención médica del empleado o consultarlo, según la gravedad de la exposición.
Nota: La mayoría de las exposiciones en el laboratorio se mitigan con el lavado minucioso de las manos y, si bien algunas son lo bastante significativas como para documentarlas y tomar las medidas tradicionales, todas son potencialmente riesgosas. - Inicie un análisis de las causas de raíz para determinar todos los hechos relativos a la exposición, las causas de raíz y un plan de acción para corregir las causas identificadas. El plan de acción debe ser elaborado, implementado y supervisado.
- Después de un incidente, tal vez sea necesario volver a capacitar al personal y revisar los manuales de procedimientos para asegurarse de que se incluyan las medidas de seguridad apropiadas.
14.3.2. Documentación de exposiciones
- Documente en un formulario de incidente de exposición todos los detalles de la exposición y todas las decisiones relacionadas con la exposición. El formulario debe ser firmado por el empleado y su supervisor inmediato.
- Recopile información del personal que pueda haber presenciado el incidente o colaborado en la limpieza.
- Brinde a los empleados acceso a servicios médicos para hacer consultas.
14.3.3. Consulta con el personal de atención de salud de los empleados
El empleado y el supervisor de un empleado que ha experimentado una posible exposición deben comunicarse con el médico o enfermero de atención de la salud de los empleados y analizar la exposición. Esos profesionales son las personas con más probabilidades de brindar orientación sobre la quimioprofilaxis oportuna y de administrar los agentes antimicrobianos apropiados.
14.3.4. Asesoramiento para los empleados expuestos
- Mantenga al empleado expuesto bien informado durante el periodo posterior a la exposición a medida que se siga recopilando y documentado información.
- Informe al empleado todos los hallazgos de la investigación sobre la exposición, la opinión del supervisor sobre el alcance de la exposición, qué medidas se espera adoptar y cuándo, a quién debe ver el empleado para una consulta médica, dónde puede hallar información adicional y qué profilaxis posterior a la exposición se recomienda y está disponible.
- Aconseje al empleado que procure asesoramiento médico y tratamiento ante cualquier enfermedad aguda que se produzca después de la exposición y durante el seguimiento. El empleado debe recibir una copia de los formularios de informe de exposición inicial y final.
14.3.5. Exposición a Mycobacterium tuberculosis
- El abordaje de situaciones en las que es probable que un empleado haya estado expuesto a Mycobacterium tuberculosis se maneja mejor mediante políticas institucionales de atención de la salud de los empleados o de control de infecciones, muchas de las cuales se basan en las pautas de los CDC (219).
- Si un empleado está expuesto a M. tuberculosis, p. ej., por posible inhalación de M. tuberculosis aerosolizada, el empleador debe hacer arreglos para que al empleado se le haga una prueba cutánea o un análisis de sangre a fin de determinar si se produjo una exposición. El resultado de esa prueba o análisis puede compararse con el resultado basal o anual previo del empleado para detectar si hubo conversión.
14.3.6. Exposición a Neisseria meningitidis
- Los empleados expuestos por vía percutánea a un aislado de N. meningitidis de un sitio estéril deben recibir tratamiento con un antibiótico apropiado.
- Los empleados con exposición por mucosas a un aislado de N. meningitidis de un sitio estéril también deben recibir quimioprofilaxis antimicrobiana.
14.3.7. Exposición a patógenos trasmitidos por sangre
- La manera más eficaz de aplicar los abordajes a la exposición por vía percutánea o de las membranas mucosas de un empleado a patógenos transmitidos por la sangre, p. ej., virus de inmunodeficiencia humana y los virus de la hepatitis B y C, es mediante políticas institucionales de atención de la salud de los empleados o de control de infecciones, muchas de las cuales se basan en las pautas de los CDC (220,221). Esas políticas se ocupan de la disponibilidad de profilaxis posterior a la exposición a los virus de la hepatitis B y la inmunodeficiencia humana.
14.4. Responsabilidades de los empleados después de una exposición
- Nunca suponga que una lesión o exposición en el laboratorio es insignificante o no tiene importancia.
- Se debe dar confianza a los empleados para que informen todos los incidentes, con el objetivo de que se protejan a sí mismos y a sus colegas y familias sin miedo a sufrir represalias. Informe todas las exposiciones al supervisor de inmediato y analice la exposición para determinar qué medidas se deben tomar si es necesario tomar medidas. Participe activamente en la documentación de la exposición y proporcione información pertinente que se usará para el desarrollo del plan de acciones correctivas.
- Coopere completamente con los procesos aprobados del laboratorio para después de una exposición y siga los consejos médicos prudentes.
- Respete las indicaciones del supervisor en la medida en que las considere razonables.
15. Educación en bioseguridad
Las iniciativas educativas en materia de bioseguridad comienzan incluso antes de que un empleado empiece a trabajar en el laboratorio. El empleador debe elaborar una descripción precisa del puesto para que el empleado comprenda las responsabilidades del trabajo. Se deben definir los conocimientos, destrezas y capacidades necesarios para el trabajo. Evalúe a los candidatos al puesto para ver si cumplen esos criterios. Desarrolle un plan de mentores y cubra cualquier brecha de la capacitación antes de colocar a los empleados en una posición en la que corran riesgo de exposición. Evalúe y documente la competencia de los empleados antes de permitirles trabajar en forma independiente.
Las oportunidades educativas para reforzar los comportamientos seguros deben ser una constante y estar respaldadas por todos los niveles de la gerencia y el personal. De acuerdo con los requisitos de la Administración de Seguridad y Salud Ocupacionales (OSHA), la educación sobre los riesgos de exposición a agentes infecciosos comienza con la primera orientación de un empleado nuevo en el laboratorio o la asignación a un trabajo técnico, y debe ser específica para las tareas que desempeña el empleado. La capacitación debe incluir una explicación del uso y las limitaciones de los métodos que reducirán o prevendrán la exposición a materiales infecciosos. Estos incluyen controles de ingeniería, prácticas laborales y equipo de protección personal. Se debe brindar una nueva capacitación anual para esos empleados en el plazo de 1 año desde su capacitación original y se debe destacar la información sobre controles de ingeniería y prácticas que sean nuevos. La capacitación anual en materia de seguridad brinda la oportunidad de repasar medidas claves de bioseguridad que tal vez se olviden con las presiones laborales cotidianas.
La responsabilidad de supervisar la educación de seguridad del personal de laboratorio debe ser asignada en forma clara. Esa responsabilidad podrá delegarse al responsable de bioseguridad o a otro integrante del personal que haya recibido capacitación adicional mediante cursos especializados o experiencia laboral y cuya competencia para realizar la capacitación se haya verificado. Dado que los análisis de laboratorio pueden realizarse fuera de un laboratorio tradicional (p. ej., consultorio médico, clínica de pacientes ambulatorios, comunidad), estas recomendaciones de capacitación y educación deben adaptarse a los empleados que realizan los análisis y a la persona que los supervisa.
15.1. Capacitación/ejercicios en bioseguridad
La capacitación de los empleados puede lograrse mediante cualquiera de varios métodos, y casi todos ellos pueden adaptarse o combinarse para satisfacer las necesidades de los empleados de un laboratorio determinado.
- Las demostraciones en vivo son eficaces porque permiten la interacción entre el trabajador del laboratorio y un experto que puede hacer y responder preguntas.
- Las demostraciones de problemas comunes o exposiciones que podrían enfrentar los científicos de laboratorio durante sus obligaciones laborales normales pueden presentarse ante una sola persona o un grupo. Esto podría hacerse adaptando (o colocando de antemano) un área de laboratorio o estación de trabajo con problemas o errores de seguridad deliberados y preguntando: “¿Qué errores observan aquí y cómo los solucionarían?” “¿Qué harían si tuvieran este problema?”. Por ejemplo:
— Prepare un gabinete de seguridad biológica (BSC) con demasiados objetos adentro o represente a alguien que entra y sale de la campana de extracción demasiadas veces.
— Practique qué hacer si se le cae un cultivo líquido, posiblemente de Mycobacterium tuberculosis, en el laboratorio de micobacteriología.
— Analice qué hacer si se envía una jeringa al laboratorio con una aguja conectada.
— ¿Cómo manejaría un tubo roto con una muestra en la centrífuga?
— Demuestre qué haría si se salpicara con una suspensión bacteriana en la cara, los ojos o la boca.
— Demuestre la forma en que se puede liberar el extremo de una pipeta y este puede rebotar y golpear al científico de laboratorio en la cara, y demuestra cuál es el procedimiento correcto.
— Analice qué hacer con una muestra que presenta una fuga en un tubo neumático. - Todos los comportamientos apropiados para evitar o subsanar violaciones de seguridad como las resaltadas en estos eventos de demostraciones deben estar descritos en la sección de prácticas y procedimientos estándares de seguridad del manual de seguridad en el laboratorio.
- Pueden presentarse representaciones mensuales breves de seguridad durante las reuniones de laboratorio programadas regularmente. Los empleados que hayan tenido un “cuasi accidente” o un incidente real pueden compartir su experiencia con sus compañeros de trabajo de acuerdo con las consideraciones de privacidad de la institución. Conocer esa información de boca de los compañeros de trabajo aumentaría su impacto. Invite a comentar y analizar soluciones creativas para prevenir problemas de bioseguridad.
- De manera alternativa, los empleados del laboratorio podrían turnarse para presentar en una reunión de personal lo que perciben como un peligro de bioseguridad. Eso también ayudaría a mantener a todos al tanto de los problemas diarios de seguridad que se olvidan con tanta facilidad en un lugar de trabajo ajetreado.
15.2. Refuerzo educativo
- El refuerzo educativo mediante comunicados y exámenes debe ser continuo y aleatorio. Los exámenes o pruebas no programados pueden ser los más eficaces porque obligan a pensar en forma rápida y deliberada cómo responder. Se podría dar un escenario específico a un tecnólogo seleccionado al azar y es posible que algunos laboratorios tengan la capacidad tecnológica de enviar pruebas de seguridad a trabajadores individuales cuando comienzan el trabajo del día. De manera alternativa, el refuerzo educativo puede ser tan simple como publicar una pregunta de la semana en el laboratorio. Esos abordajes permitirían que los ejercicios de seguridad se lleven a cabo en todos los turnos.
- Si no es posible realizar presentaciones en reuniones, se pueden compartir “acertijos de seguridad” breves escritos en una sola hoja en la sala de descanso mientras se toma un café, o se pueden pegar en los casilleros o en el tablero de anuncios del laboratorio. Un ejemplo podría ser el formato “¿Cuál es el error en esta imagen?"
— Muestre una fotografía de una persona que está trabajando con mohos fuera del gabinete de bioseguridad.
— Muestre a alguien que está trabajando en el gabinete de bioseguridad con objetos que obstruyen la salida de la campana de extracción de bioseguridad.
|— Muestre a una persona tratando con vórtice suspensiones bacterianas para un análisis de susceptibilidad antimicrobiana sin colocar la tapa en el tubo.
— Publique las respuestas correctas en la siguiente prueba de seguridad. - Los carteles que recuerden al personal cumplir con las políticas de seguridad podría aumentar la toma de conciencia y el cumplimiento. La OSHA, los CDC y otras organizaciones proporcionan material de trabajo de respaldo que se puede descargar e imprimir. No obstante, dado que los carteles que no se cambian pierden su eficacia rápidamente, rote los carteles con mensajes nuevos diseñados para mantener al personal alerta con respecto a los peligros en las estaciones de trabajo.
- Consulte el sitio web de la Asociación Estadounidense de Seguridad Biológica (American Biological Safety Association) (http://www.absa.org/resbslinks.html), donde encontrará enlaces a numerosos organismos del gobierno y otras organizaciones profesionales, normas/reglamentaciones/pautas, información sobre bioseguridad y bioterrorismo, enlaces y artículos técnicos e información sobre su curso de revisión de bioseguridad de una semana de duración.
15.3. Lista de comprobación anual de elementos y procedimientos de seguridad fundamentales
No hay un conjunto “oficial” de preguntas para una lista de comprobación anual. Si bien hay muchas actividades comunes que podría realizar todo el personal, personalice la lista para que refleje las obligaciones laborales reales. Analice cada estación de trabajo con respecto al tipo de riesgo de bioseguridad asociado con la estación, y adapte la lista a cada uno de esos riesgos. Si resulta práctico, pida a los empleados del laboratorio que confeccionen un borrador de sus propias listas de comprobación para las tareas que realizan y que el supervisor y el encargado de seguridad revisen la lista de cada empleado.
15.4. Evaluación y documentación
Se debe documentar la capacitación de los empleados y la evaluación de competencia para lo siguiente:
- Construir y rotular adecuadamente recipientes para residuos médicos;
- Respetar todas las reglamentaciones federales, estatales y locales con respecto a la gestión de residuos, lo que incluye la manipulación, el desecho y el almacenamiento de residuos médicos;
- Transporte de residuos médicos, incluido cualquier rótulo exigido por el Departamento de Transporte (DOT) para los recipientes usados para el transporte (p. ej., el rótulo “sustancia infecciosa conocida”);
- Transporte de muestras;
- Uso de los suministros apropiados (p. ej., recipientes, bolsas de plástico, rótulos) para el transporte de todas las muestras de laboratorio tanto dentro como fuera del centro hospitalario;
- Respetar todas las reglamentaciones federales, estatales y locales con respecto al transporte de muestras de laboratorio; y
- Transporte de muestras fuera de las instalaciones (93).
15.5. Supervisión del cumplimiento con los procedimientos de seguridad
- Para reforzar la importancia de la capacitación y educación en materia de seguridad, incorpórela a la revisión anual de desempeño. Durante esta revisión, asegúrese de que el empleado participa en la capacitación anual, respeta las políticas y participa en forma activa en las pruebas de seguridad realizadas a todo el personal del laboratorio. Aquellos que hayan experimentado una serie de incidentes durante el período de evaluación deben recibir asesoramiento y una repetición de la capacitación más intensa en esas áreas.
- Asegúrese de que los empleados comprendan la importancia de informar los incidentes al departamento de salud de los empleados y a su supervisor o gerente. Explique que eso es importante para la protección de los empleados y que relacionar una lesión o infección con un incidente que tal vez haya ocurrido en el lugar de trabajo ayudará a compensar al empleado adecuadamente y a mejorar las prácticas para proteger a los demás.
- Desarrolle un plan de control de exposiciones inmediato mediante el cual un empleado de laboratorio sea sometido de manera “optimizada” al proceso de atención de la salud de los empleados y, por lo tanto, sea más probable que informe un incidente.
- El supervisor o gerente debe hacer un seguimiento de todos los empleados que hayan tenido un problema, a fin de protegerlos y asegurarse de que se supervisen estos incidentes y se eliminen los riesgos sistemáticos.
- Realice una revisión anual de los controles de ingeniería, ya que los cambios en las prácticas y la tecnología podrían implicar riesgos nuevos para el personal del laboratorio. Los controles de ingeniería nuevos deben ser revisados por las personas apropiadas según sea necesario, p. ej., el responsable de seguridad, la gerencia de riesgos, el personal de compras o los empleados que usan agujas y demás objetos cortopunzantes en el transcurso de sus obligaciones.
- Las secciones del laboratorio pueden designar a un “capitán de seguridad del mes” y rotar el cargo entre los empleados. El capitán de seguridad debe reforzar los buenos comportamientos de seguridad y alentar a los compañeros de trabajo a cumplir las políticas de seguridad.
- Reserve las medidas punitivas para violaciones mayores o repetidas, y cree una actitud positiva con respecto a la seguridad, en lugar de una negativa que tenga consecuencias administrativas. En ese aspecto, el personal del laboratorio se podría convertir en un equipo de “compradores” de seguridad, al que se podría alentar a informar cualquier idea nueva relacionada con la seguridad implementada por el personal, además de ejemplos de prácticas o situaciones inseguras que observen en el laboratorio. El propósito no es denunciar a las personas sino promover un ambiente laboral seguro y describir situaciones que observen en las que no se estén siguiendo prácticas seguras, de modo que se pueda reforzar y reconocer la seguridad en la siguiente reunión de personal.
16. Mejora continua de la calidad
Integre la mejora continua de la calidad en materia de bioseguridad con la mejora continua de la calidad para todo el laboratorio. Los 12 puntos básicos de los sistemas de calidad, según los define el Instituto de Estándares Clínicos y de Laboratorio, aportan una base integral y una fuente de referencia para la mejora continua de la calidad (222). Para cada uno de esos elementos se han enumerado consideraciones de bioseguridad más detalladas y específicas (Tabla 17).
Agradecimientos
Agradecemos la ayuda de Tanya Graham, DVM, South Dakota State University, Brookings, SD; Larry Thompson, DVM, PhD, Nestle Purina Pet Care, St. Louis, MO; R. Ross Graham, DVM, PhD, Merrick and Company; Corrine Fantz, PhD, Emory University, Atlanta, GA; Thomas Burgess, PhD, y Quest Diagnostics, Tucker, GA.
Agradecemos la revisión y los comentarios del documento provistos por la Oficina de Salud y Seguridad, CDC; American Association of Veterinary Laboratory Diagnosticians; American Biological Safety Association; College of American Pathologists; American Society for Microbiology; Association of Public Health Laboratories; y expertos en el tema de los CDC.
Referencias
- CDC/National Institutes of Health. Biosafety in microbiological and biomedical laboratories. 5th ed. Available at http://www.cdc.gov/biosafety/publications/bmbl5/BMBL.pdf.
- Clinical and Laboratory Standards Institute. Protection of laboratory workers from occupationally acquired infections; approved guideline—fourth edition (CLSI document M29-A4). Wayne, PA: Clinical and Laboratory Standards Institute; 2011. In press.
- CDC. Laboratory-acquired vaccinia exposures and infections—United States, 2005–2007. MMWR 2008;57:401–4.
- CDC. Laboratory-acquired brucellosis—Indiana and Minnesota, 2006. MMWR 2008;57:39–42.
- CDC. Update: potential exposures to attenuated vaccine strain Brucella abortus RB51 during a laboratory proficiency test—United States and Canada, 2007. MMWR 2008;57:36–9.
- CDC. Laboratory exposure to Burkholderia pseudomallei—Los Angeles, California, 2003. MMWR 2004;53:988–90.
- CDC. Laboratory-acquired meningococcal disease—United States, 2000. MMWR 2002;51:141–4.
- CDC. Suspected cutaneous anthrax in a laboratory worker—Texas, 2002. MMWR 2002;51:279–81.
- CDC. Laboratory-acquired West Nile virus infections—United States, 2002. MMWR 2002;51:1133–5.
- CDC. Laboratory-acquired human glanders—Maryland, May 2000. MMWR 2000;49:532–5.
- CDC. Epidemiologic notes and reports. Laboratory-acquired meningococcemia—California and Massachusetts. MMWR 1991;40:46–47,55.
- Jacobson JT, Orlob RB, Clayton JL. Infections acquired in clinical laboratories in Utah. J Clin Microbiol 1985;21:486–9.
- Harrington JM, Shannon HS. Incidence of tuberculosis, hepatitis, brucellosis, and shigellosis in British medical laboratory workers. Br Med J 1976;1:759–62.
- Reid DD. Incidence of tuberculosis among workers in laboratories. Br Med J 1957;2:10–14.
- Vesley D, Hartmann HM. Laboratory-acquired infections and injuries in clinical laboratories: a 1986 survey. Am J Public Health 1988;78:1213–15.
- Walker D, Campbell D. A survey of infections in United Kingdom laboratories, 1994–1995. J Clin Pathol 1999;52:415–8.
- Sejvar JJ, Johnson D, Popovic T, et al. Assessing the risk of laboratory-acquired meningococcal disease. J Clin Microbiol 2005;43:4811–14.
- Sewell DL. Laboratory-associated infections and biosafety. Clin Microbiol Rev 1995;8:389-405.
- Pike RM. Laboratory-associated infections: incidence, fatalities, causes, and prevention. Annu Rev Microbiol 1979;33:41–66.
- Herwaldt, BL. Laboratory-acquired parasitic infections from accidental exposures. Clin Microbiol Rev 2001;14:659–88.
- Pragay DA, Howard SF, Gill ES. Clinical laboratory accidents, and some recommended remedies. Clin Chem 1980;26:1107–8.
- Kyes K. Blood safety. Clinical Laboratory Products. June 2007. Available at http://www.clpmag.com/issues/articles/2007-06_02.asp.
- Collins CH. Laboratory-acquired infections: history, incidence, causes, and prevention. 3rd ed. London: Butterworth-Heinemann, Ltd; 1993.
- Pike RM. Laboratory-associated infections: incidence, fatalities, causes, and prevention. Annu Rev Microbiol 1979;33:41–66.
- Pike RM. Laboratory-associated infections: summary and analysis of 3921 cases. Health Lab Sci 1976;13:105–14.
- Pike RM. Past and present hazards of working with infectious agents. Arch Pathol Lab Med 1978;102:333–6.
- Harding AL, Byers KB. Epidemiology of laboratory-associated infections. In: Fleming DO, Hunt DL, eds. Biological safety: principles and practices. 3rd ed. Washington, DC: ASM Press; 2000:35–54.
- Vesley D, Hartmann HM. Laboratory-acquired infections and injuries in clinical laboratories: a 1986 survey. Am J Public Health. 1988;78:1213–15.
- National Fire Protection Association. Section 5.1.3.3.2 (7). In: NFPA 99 Standard for health care facilities, 2005 Edition., Quincy, MA: National Fire Protection Association; 2005:37.
- Zohar D. The effects of leadership dimensions, safety climate, and assigned priorities on minor injuries in work groups. Journal of Organizational Behavior 2002;23:75–92.
- Zohar D, Luria G. A multilevel model of safety climate: Cross-level relationships between organization and group-level climates. J. Appl Psychol 2005;90:616–28.
- Clinical and Laboratory Standards Institute. Laboratory design: approved guideline—second edition (CLSI document GP18-A2). Wayne, PA: Clinical and Laboratory Standards Institute; 2007.
- Occupational Safety and Health Administration. Occupational safety and health standards. Z. Toxic and hazardous substances. Bloodborne pathogens. Standard no.1910.1030. Available at http://www.osha.gov/pls/oshaweb/owadisp.show_document?p_table=standards&p_id=10051.
- International Federation of Biosafety Associations. Biosafety compendium on regulations and information sources. Available at http://www.internationalbiosafety.org/english/internlCompendium.asp.
- American Biological Safety Organization. Available at http://www.absa.org.
- World Health Organization. Laboratory biosafety manual, 3rd edition. Geneva: World Health Organization, 2004. Available at http://www.who.int/csr/resources/publications/biosafety/Biosafety7.pdf.
- Occupational Safety and Health Administration. Occupational safety and health standards. I. Personal protective equipment. Standard no. 1910.132. Available at http://www.osha.gov/pls/oshaweb/owadisp.show_document?p_table=STANDARDS&p_id=9777.
- Rutala W, Weber D. Use of inorganic hypochlorite (bleach) in health-care facilities. Clin Microbiol Rev 1997;597–610.
- Clinical and Laboratory Standards Institute. Clinical laboratory waste management; approved guideline—third edition (CLSI document GP05-A3). Wayne, PA: Clinical and Laboratory Standards Institute; 2011.
- CDC, US Department of Agriculture, Animal and Plant Health Inspection Service. National select agent registry. Available at http://www.selectagents.gov.
- Miller JM. The Select Agent Rule and its impact on clinical laboratories. Clin Microbiol Newsletter 2006;28(8):57–63.
- Johansen BV. Hazards related to EM-laboratory instrumentation. Ultrastruct Pathol 1984;7:219–25.
- Bance GN, Barber VC, Sholdice JA. Safety in the SEM laboratory—1981 update. Scan Electron Microsc 1981;II:87–94.
- Fleming DO, Richardson JH, Tulis JJ, Vesley D. Laboratory safety: principles and practices. 2nd ed. Washington DC: American Society for Microbiology; 1995.
- Clinical and Laboratory Standards Institute. Implementing a needlestick and sharps injury prevention program in the clinical laboratory (CLSI document CLSI X03RE). Wayne, PA: Clinical and Laboratory Standards Institute; 2002.
- CDC. Guidelines for preventing the transmission of Mycobacterium tuberculosis in health-care settings, 2005. MMWR 2005;54(No. RR-17).
- Collins CH. Laboratory acquired infections. Med Lab Sci 1980;37:291–8.
- Chatigny MA, Hatch MT, Wolochow H, et al. Studies on release and survival of biological substances used in recombinant DNA laboratory procedures. Recombinant DNA technical bulletin. Bethesda, MD: US Department of Health and Human Services, National Institutes of Health. 1979.
- Wiedbrauk DL, Stoerker J. Quality assurance in the molecular virology laboratory. In: Wiedbrauk DL, Farkas DH, eds. Molecular methods for virus detection. San Diego, CA: Academic Press; 1995: 25–37.
- Darlow HM. Safety in the microbiology laboratory: an introduction. In: Shapton DA, Board RG, eds. Safety in microbiology. London: Oficina de Prensa del Departamento de Agricultura de Estados Unidos: (1972) 1-19
- Schmid I, Lambert C, Ambrozak D, Marti GE, Moss DM, Perfetto SP. International Society for Analytical Cytology biosafety standard for sorting of unfixed cells. Cytometry Part A. 2007;6:414–37.
- Kubica GP. Your tuberculosis laboratory: are you really safe from infection? Clinical Microbiology Newsletter 1990;12:85–7.
- Murray PR, Baron EJ, Horgensen JH, Pfaller MA, Yolken RH. Manual of clinical microbiology, Eighth edition. Washington, DC: ASM Press; 2003.
- Fleming DO, Hunt DL. Biological safety: principles and practices. Washington, DC: ASM Press; 2006.
- Occupational Safety and Health Administration. Occupational safety and health standards. I. Personal protective equipment: Respiratory protection. Standard no. 1910.134. Section 4. Available at http://www.osha.gov/pls/oshaweb/owadisp.show_document?p_table=STANDARDS&p_id=12716.
- Nolte K, Taylor D, Richmond J. Biosafety considerations for autopsy. Am J Forensic Med Pathol 2002;23(2):107–22.
- Collins C, Grange J. Tuberculosis acquired in laboratories and necropsy rooms. Communicable Disease and Public Health 1999;2:161–7.
- Burnett L, Lunn G, Coico R. Biosafety: guidelines for working with pathogenic and infectious microorganisms. In: Curr Protoc Microbiol.[serial online] May 2009; DOI: 10.1002/9780471729259.mc01a01s13.
- Nolte KB, Foucar K, Richmond JY. Hanta viral biosafety issues in the autopsy room and laboratory: concerns and recommendations. Hum Pathol 1996;27:1253–4.
- De Carli G, Puro V, Scognamiglio P, Ippolito G. Infection with hepatitis C virus transmitted by accidental needlesticks. Clin Infect Dis 2003;37:1718–9.
- Nyberg M, Suni J, Haltia M. Isolation of human immunodeficiency virus (HIV) at autopsy one to six days postmortem. Am J Clin Pathol 1990;94:422–5.
- Petrosillo N, Puro V, De Carli G, Ippolito G, SIROH Group. Risks faced by laboratory workers in the AIDs era. J Biol Regul Homeost Agents 2001;15:243–8.
- CDC. Updated US Public Health Service guidelines for the management of occupational exposures to HBV, HCV, and HIV and recommendations for postexposure prophylaxis. MMWR 2001;50(No. RR-11).
- Brown P, Gibbs CJ, Gajdusek D, Cathala F, LaBauge R. Transmission of Creutzfeldt-Jakob disease from formalin-fixed, paraffin-embedded human brain tissue. N Engl J Med 1986;315:1614–5.
- Sitwell L LB, Attack E, Izukawa, D. Creutzfeldt-Jakob disease in histopathology technicians N Engl J Med 1988;318:854.
- Wilkins D WA, Cossar YE, Miller DC. Creutzfeldt-Jakob disease in histopathology technicians. N Engl J Med 1988;318:853–4.
- Miller D. Creutzfeldt-Jakob disease in histopathology technicians. N Engl J Med 1988;318:853–4.
- Canadian Food Inspection Agency. Biosafety guidelines developed for National TSE Veterinary Diagnostic Laboratory Network. Version 1.0, March 8, 2002.
- Newsom S, Rowlands C, Mathews J, Elliot CJ. Aerosols in the mortuary. J Clin Pathol 1983;36:127–32.
- Occupational Safety and Health Administration. Occupational safety and health standards. Z. Toxic and hazardous substances. 1910.1048, Formaldehyde. Available at http://www.osha.gov/pls/oshaweb/owadisp.show_document?p_table=STANDARDS&p_id=10075.
- Code of Federal Regulations. Title 40, Protection of Environment. Available at http://ecfr.gpoaccess.gov/cgi/t/text/text-idx?c=ecfr;sid=4990e762d7b81851bef18f82dc851826;rgn0=div5;view=text;node=40%3A25.0.1.1.2;idno=40;cc=ecfr#40:25.0.1.1.2.3.1.5.
- Occupational Safety and Health Administration. Occupational safety and health standards. I. Personal protective equipment. 1910.133, Eye and face protection. Available at http://www.osha.gov/pls/oshaweb/owadisp.show_document?p_table=STANDARDS&p_id=9778.
- National Tuberculosis Advisory Committee. Guidelines for Australian Mycobacteriology Laboratories. Communicable Diseases Intelligence 2006;30:116–28.
- Hedwell E. Incidence of tuberculosis among medical students at Lund University. American Review of Tuberculosis 1940;41:770–80.
- Weston J, Locker G. Frequency of glove puncture in the postmortem room. J Clin Pathol 1992;45:177–8.
- Templeton GL, Illing LA, Young L, Cave D, Stead WW, Bates JH. The risk for transmission of Mycobacterium tuberculosis at the bedside and during autopsy. Ann Intern Med 1995;122:922–5.
- Meyer J. TB Plagues Office of the LA Coroner. Los Angeles Times April 25, 1997;A1–27. Available at http://articles.latimes.com/1997-04-25/news/mn-52228_1_coroner-s-office.
- Kappel T, Reinarts J, Schmid J, Holter J, Azar M. The viability of Mycobacterium tuberculosis in formalin-fixed pulmonary autopsy tissue: review of the literature and brief report. Hum Pathol 1996;27:1361–4.
- Ford A. Taking stock of biosafety perils in surg path. CAP Today 2009;23:1.
- Gärtner H-V, Seidl C, Luckenbach C, et al. Genetic analysis of a sarcoma accidentally transplanted from a patient to a surgeon. N Engl J Med 1996;335:1494–7.
- Goette D, Jacobson, KW, Doty RD. Primary inoculation tuberculosis of the skin; prosector's paronychia. Arch Dermatol 1978;114:567–9.
- Vetter J. Microbial aerosols from a freezing microtome. American Society for Clinical Microbiology Summary Report; 1977.
- CDC. Tuberculosis infection associated with tissue processing—California. MMWR 1981;30(6):73–4.
- Smith J. The hazard to pathologists from tuberculosis specimens. Hum Pathol 1996;27:1251–2.
- Gerston K, Blumberg L, Tshabalala V, Murray J. Viability of mycobacteria in formalin-fixed lungs. Hum Pathol 2004;35:571–5.
- Richard M, Biacabe A, Perret-Liaudet A, McCardle L, Ironside J, Kopp N. Protection of personnel and environment against Creutzfeldt-Jakob disease in pathology laboratories. Clin Expl Pathol 1999;47:192–200.
- Clinical and Laboratory Standards Institute. Procedures for the recovery and identification of parasites from the intestinal tract; approved guideline—second edition (CLSI document M28-A2). Wayne, PA: Clinical and Laboratory Standards Institute; 2005.
- Wheatley W. A rapid staining procedure for intestinal amoebae and flagellates. Am J Clin Pathol 1951;21:990–1.
- Garcia LS. Diagnostic medical parasitology, 5th ed. Washington, DC: ASM Press; 2007.
- International Air Transport Association. 2005[a]. Dangerous Goods Regulations, 46th edition. Montreal, Canada: International Air Transport Association; 2005.
- International Air Transport Association. 2005[b]. Dangerous Goods Regulations, 46th ed. Addendum II. March 22. Montreal, Canada: International Air Transport Association; 2005.
- International Air Transport Association. 2005[c]. Dangerous Goods Regulations, 46th ed. Addendum III. July 5. Montreal, Canada: International Air Transport Association; 2005.
- US Department of Transportation, Pipeline and Hazardous Materials Safety Administration. Hazardous materials: infectious substances; harmonization with the United Nations recommendations; final rule (49 CFR Parts 171 et al.). Federal Register 2006;71:32244–63. Available at https://hazmatonline.phmsa.dot.gov/services/publication_documents/Transporting%20Infectious%20Substances%20Safely.pdf.
- US Department of Transportation, Research and Special Programs Administration. Harmonization with the United Nations Recommendations, International Maritime Dangerous Goods Code, and International Civil Aviation Organization's Technical Instructions; final rule (CFR 42, Parts 171, 172, et al.). Federal Register 2004;69:76044–76187 (http://www.labsafety.com/refinfo/fedreg/FRPDF/122004.pdf).
- US Department of Transportation, Research and Special Programs Administration. Hazardous materials: revision to standards for infectious substances and genetically modified organisms; final rule (CFR 42, Parts 171 et al.). Federal Register 2002;67:53118–53144.
- US Postal Service. Domestic mail manual. Hazardous materials (601.10.1). 2011. Available at http://pe.usps.com/cpim/ftp/manuals/dmm300/full/mailingStandards.pdf.
- World Health Organization. Transport of infectious substances. Background to the 17 amendments adopted in the 13th revision of the United Nations Model Regulations guiding the transport of infectious substances. Geneva: World Health Organization; 2004. Available at http://www.who.int/csr/resources/publications/WHO_CDS_CSR_LYO_2004_9/en.
- World Health Organization. 2005. Guidance on Regulations for the Transport of Infectious Substances 2009–2010. Geneva: World Health Organization; 2009. Available at http://www.who.int/csr/resources/publications/biosafety/WHO_HSE_EPR_2008_10/en/index.html.
- Garcia LS, Shimizu RY, Shum A, Bruckner DA. Evaluation of intestinal protozoan morphology in polyvinyl alcohol preservative: comparison of zinc sulfate and mercuric chloride based compounds for use in Schaudinn's fixative. J Clin Microbiol 1993;31:307–10.
- Jungbauer FH, van der Harst JJ, Groothoff JW, Coenraads PJ. Skin protection in nursing work: promoting the use of gloves and hand alcohol. Contact Dermatitis 2004;51:135–40.
- Kampf G, Kramer A. Epidemiologic background of hand hygiene and evaluation of the most important agents for scrubs and rubs. Clin Microbiol Rev 2004;17:863–93.
- CDC. A comprehensive immunization strategy to eliminate transmission of hepatitis B virus infection in the United States. Recommendations of the Advisory Committee on Immunization Practices. Part II: Immunization of adults. MMWR 2006;55(No. RR-16).
- Calcofluor white reagent dropper (material safety data sheet). Franklin Lakes, NJ: Becton Dickinson; 2011. Available at http://www.bdregdocs.com/msds/view/msds-usa-261195.pdf.
- Potassium hydroxide 10% w/v (material safety data sheet). Austin, TX: Science Stuff, Inc.; 2006. Available at http://www.sciencestuff.com/msds/C2360.html.
- Calcobrite fungi staining kit (material safety data sheet). Guildford, UK: Clin-Tech, LTD; 2009. Available at http://www.clin-tech.co.uk/msds/63115X.pdf.
- Potassium hydroxide (10–45%) solutions and concentrates (material safety data sheet). Phillipsburg, NJ: Mallinckrodt Baker, Inc.; 2008. Available at http://www.jtbaker.com/msds/englishhtml/P5887.htm.
- Lactophenol cotton blue stain droppers (material safety data sheet). Franklin Lakes, NJ: Becton Dickinson; 2003. Available athttp://www.bd.com/ds/productCenter/261188.asp.
- BactiDrop lactophenol aniline blue (material safety data sheet). Hants, UK: Oxoid; 2007. Available at http://www.oxoid.com/pdf/msds/EN/R21526.pdf.
- Lactophenol–cotton blue mounting fluid (material safety data sheet). Gibbstown, NJ: EMD Chemicals; 2010. Available at http://www.emdchemicals.com/lactophenol/EMD_CHEM-R03465/p_uuid?attachments=MSDS.
- Higgins waterproof black drawing India ink (material safety data sheet). Bellwood, IL: Sanford Corporation; 2001. Available at http://web.grcc.cc.mi.us/Pr/msds/visualarts-photography/HIGGINS%20Waterproof%20Black%20Drawing%20Indian%20Ink.pdf.
- Methenamine silver stain (package insert). Carpinteria, CA: Dako North America; 2008. Available at http://www.dako.com/us/searchresultlist?search=methenamine+silver+stain.
- Giemsa stain (material safety data sheet). Torrance, CA: Medical Chemical Corp.; 2006. Available at http://www.med-chem.com/msds/591A.pdf.
- Larone DH. Medically important fungi, a guide to identification, 4th ed., Washington, DC: ASM Press; 2002.
- Stevens DA, Clemons KV, Levine HB, et al. Expert opinion: what to do when there is Coccidioides exposure in a laboratory. Clin Infect Dis 2009; 49:919–23.
- Indoor allergens: assessing and controlling adverse health effects. In: Pope AM, Patterson R, eds. Washington, DC: National Academy Press; 1993.
- Occupational allergy to antibiotics. Med Pr 1986;37:383–7.
- Coutts II, Dally MB, Taylor AJ, Pickering CA, Horsfield N. Asthma in workers manufacturing cephalosporins. Br Med J (Clin Res Ed) 1981;283:950.
- Davies RJ, Hendrick DJ, Pepys J. Asthma due to inhaled chemical agents: ampicillin, benzyl penicillin, 6 amino penicillanic acid and related substances. Clin Allergy 1974;4:227-47.
- Malo J-L, Cartier A. Occupational asthma in workers of a pharmaceutical company processing spiramycin. Thorax 1988;45:371–7.
- Paggiaro PL, Loi AM, Toma A. Bronchial asthma and dermatitis due to spiramycin in a chick breeder. Clin Allergy 1979;9:571–4.
- Bance GN, Barber VC, Sholdice JA. Safety in the SEM laboratory—1981 update. Scan Electron Microsc 1981;II:87–94.
- Drury P. Safety in electron microscopy and protective glove hazards. Can J Med Technol 1980;42:80–2.
- Pegum JS, Medhurst FA. Dermatitis from penetration of rubber gloves by acrylic monomer. Br Med J 1971;276:141–3.
- Tobler M, Wüthrich B, Freiburghaus AU. Contact dermatitis from acrylate and methacrylate compounds in Lowicryl embedding media for electron microscopy. Contact Dermatitis 1990;23:96–102.
- Lunn G, Sansone EB. Ethidium bromide: destruction and decontamination of solutions. Anal Biochem 1987;162:453–8. PMID 3605608.
- Gärtner HV, Seidl C, Luckenbach C, et al. Genetic analysis of a sarcoma accidentally transplanted from a patient to a surgeon. N Engl J Med 1996;335:1494–6.
- Nadler SH, Moore GE. Immunotherapy of malignant disease. Arch Surg 1969;99:376–81.
- Scanlon EF, Hawkins RA, Fox WW, Smith WS. Fatal homotransplanted melanoma: a case report. Cancer 1965;18:782–89.
- Southam CM. Homotransplantation of human cell lines. Bull NY Acad Med 1958;34:416–23.
- Blohme I, Nyberg G, Jeansson S, Svalander C. Adenovirus infection in a renal transplant patient. Transplant Proc 1992;24:295.
- Myerowitz RL, Stalder H, Oxman MN, et al. Fatal disseminated adenovirus infection in a renal transplant recipient. Am J Med 1975;59:591–8.
- Asim M, Chong-Lopez A, Nickeleit V. Adenovirus infection of a renal allograft. Am J Kidney Dis 2003;41:696–701.
- Hsuing GD. Latent virus infections in primate tissues with special reference to simian viruses. Bacteriol Rev 1968;32:185–205.
- Swack NS, Hsuing GD. Endogenous agents in primary cell cultures with special reference to latent viruses. In Vitro 1974;10:260–7.
- Hopps HE. Origin of endogenous and exogenous agents in cell cultures. In Vitro 1974;10:243–6.
- Patel R, Paya CV. Infections in solid-organ transplant recipients. Microbiol Rev 1997;10:86–124.
- van Gelder T, Kroes LC, Mulder A, Gratama JW, Weimar W. A living-related kidney donor as the source of a nearly fatal primary Epstein-Barr virus infection following transplantation. Transplantation 1994;58:852–4.
- Davis C, Gretch DR, Carithers RL. Hepatitis B and transplantation. Infect Dis Clin North Am 1995;9:925–41.
- Dummer JS, Armstrong J, Somers J, et al. Transmission of infection with herpes simplex virus by renal transplantation. J Infect Dis 1987;155:202–6.
- Goodman JL. Possible transmission of herpes simplex virus by organ transplantation. Transplantation 1989;47:609–13.
- Schwarz A, Hoffmann F, L'age-Stehr, J, Tegzess AM, Offermann G. Human immunodeficiency virus transmission by organ donation. Outcome in cornea and kidney recipients. Transplantation 1987;1:21–4.
- Sotir M, Switzer W, Schable C, Schmitt J, Vitek C, Khabbaz RF. Risk of occupational exposure to potentially infectious nonhuman primate materials and to simian immunodeficiency virus. J Med Primatol 1997;26:233–40.
- Khabbaz RF, Rowe T, Murphey-Corb M, et al. Simian immunodeficiency virus needlestick accident in a laboratory worker. Lancet 1992;340:271–3.
- Gonzalez-Perez MP, Munoz-Juarez L, Cardenas FC, Zarranz Imirizaldu JJ, Carranceja JC, Garcia-Saiz A. Human T-cell leukemia virus type I infection in various recipients of transplants from the same donor. Teléfono 2009751006-11
- Nakatsuji Y, Sugai YF, Watanabe S, et al. HTLV-I-associated myelopathy manifested after renal transplantation. J Neurol Sci 2000;177:154–6.
- Remesar MC, del Pozo AE, Pittis MG, Mangano AM, Sen L, Briones L. Transmission of HTLV-I by kidney transplant. Transfusion 2000;40:1421–2.
- Toro C, Rodes B, Poveda E, Soriano V. Rapid development of subacute myelopathy in three organ transplant recipients after transmission of human T-cell lymphotropic virus type I from a single donor. Transplantation 2003;75:102–4.
- CDC. Lymphocytic choriomeningitis virus infection in organ transplant recipients—Massachusetts, Rhode Island, 2005. MMWR 2005;54:537–9.
- Dykewicz CA, Dato VM, Fisher-Hoch SP, Ostroff SM, Gary H Jr, McCormick JB. Lymphocytic choriomeningitis outbreak associated with nude mice in a research institute. JAMA 2010;267:1349–53.
- Mahy BW, Dykewicz C, Fisher-Hoch S, Ostroff S, Sanchez A. Virus zoonoses and their potential for contamination of cell cultures. Dev Biol Stand 1991;75:183–9.
- Schmitt M, Pawlita M. High-throughput detection and multiplex identification of cell contaminations. Nucleic Acids Res Advance Access 2009;37(18):e119. Available at http://nar.oxfordjournals.org/content/37/18/e119.full.
- Emery JB, York CJ. Occurrence of a hemadsorption virus in normal monkey tissue culture. Virology 1960;11:313–5.
- Mengling WL. Porcine parvovirus: frequency of naturally occurring transplacental infection and viral contamination of fetal porcine kidney cell cultures. Am J Vet Res 1975;36:41–4.
- Srinivasan A, Burton EC, Kuehnert MJ, et al. Transmission of rabies virus from an organ donor to four transplant recipients. N Engl J Med 2005;352:1103–11.
- Robertson I. Corneal transplants and rabies. Med J Aust 1979;2:697.
- Martín-Dávila P, Fortún J, López-Vélez R, et al. Transmission of tropical and geographically restricted infections during solid-organ transplantation. Clin Microbiol Rev 2008;21:60–96.
- Javadi MA, Fayaz A, Mirdehghan SA, Ainollahi B. Transmission of rabies by corneal graft. Cornea 2009;15:431–3.
- Houff SA, Burton RC, Wilson RW, et al. Human-to-human transmission of rabies virus by corneal transplant. N Engl J Med 1979;300:603–4.
- Hellenbrand W, Meyer C, Rasch G, Steffens T, Amon A. Cases of rabies in Germany following organ transplantation. Eur Surveill 2005;10:E050224.
- Gode GR, Bhide NK. Two rabies deaths after corneal grafts from one donor. Lancet 1988;2:791.
- CDC. Human-to-human transmission of rabies via corneal transplant—Thailand. MMWR. 1981;30:473–4.
- Baer GM, Shaddock JH, Houff SA, Harrison AK, Gardner JJ. Human rabies transmitted by corneal transplant. Arch Neurol 2009;39:103–7.
- Patient received cornea: rabies case linked to transplant. American Medical News 1978;21:3.
- Hull RN, Minner JR, Smith JW. New viral agents recovered from tissue cultures of monkey kidney cells. I. Origin and properties of cytopathic agents SV1, SV2, SV4, SV5, SV6, SV11, SV12, and SV15. Am J Hyg 1956;63:204–15.
- Rustigian R, Johnston T, Reihart H. Infection of monkey kidney tissue cultures with virus-like agents. Proc Soc Exp Biol Med 1955;88:8–16.
- Peden K, Sheng L, Yacobucci M, et al. Recovery of strains of the polyomavirus SV40 from rhesus monkey kidney cells dating from the 1950s to the early 1960s. Virology 2008;370:63–76.
- Sweet BH, Hilleman MR. The vacuolating virus, SV40. Proc Soc Exp Biol Med 1960;105:420–7.
- Kekarainen T, Martínez-Guinó L, Segalés J. Swine torque teno virus detection in pig commercial vaccines, enzymes for laboratory use and human drugs containing components of porcine origin. J Gen Virol 2000;90:648–53.
- Middleton PG, Miller S, Ross JA, Steel CM, Guy K. Insertion of SMRV-H viral DNA at the c-myc gene locus of a BL cell line and presence in established cell lines. Int J Cancer 1992;54:451–4.
- Sun R., Grogan E, Shedd D, et al. Transmissible retrovirus in Epstein-Barr virus-producer B95-8 cells. Virology 1995;209:374–83.
- Antony S. Severe meningo-encephalitis and death in a renal transplant recipient resulting from West Nile virus infection. J Natl Med Assoc 2004;96:1646–7.
- Armali Z, Ramadan R, Chlebowski A, Azzam ZS. West Nile meningo-encephalitis infection in a kidney transplant recipient. Transplant Proc 2003;35:2935–6.
- Bragin-Sanchez D, Chang PP. West Nile virus encephalitis infection in a heart transplant recipient: a case report. J Heart Lung Transplant 2005;24:621–3.
- CDC. West Nile virus activity–United States, September 26–October 2, 2002, and investigations of West Nile virus infections in recipients of blood transfusion and organ transplantation. JAMA 2002;288:1975–6.
- CDC. West Nile virus infection in organ donor and transplant recipients–Georgia and Florida, 2002. JAMA 2002;288:1465–6.
- CDC. Update: West Nile virus screening of blood donations and transfusion-associated transmission—United States. MMWR 2004;53:281–4.
- CDC. Transfusion-associated transmission of West Nile virus—Arizona, 2004. MMWR. 2004;53:842–4.
- CDC. West Nile virus infections in organ transplant recipients—New York and Pennsylvania, August–September, 2005. MMWR 2005;54:1021–3.
- DeSalvo D, Roy-Chaudhury P, Peddi R, et al. West Nile virus encephalitis in organ transplant recipients: another high-risk group for meningoencephalitis and death. Transplantation 2004;77.
- Hardinger KL, Miller B, Storch GA, Desai NM, Brennan DC. West Nile virus-associated meningoencephalitis in two chronically immunosuppressed renal transplant recipients. Am J Transplant 2003;3:1312–5.
- Harrington T, Kuehnert MJ, Kamel H, et al. West Nile virus infection transmitted by blood transfusion. Transfusion 2003;43:1018–22.
- Iwamoto M, Jernigan DB, Guasch A, et al. Transmission of West Nile virus from an organ donor to four transplant recipients. N Engl J Med 2003;348:2196–203.
- Kleinschmidt-DeMasters BK, Marder BA, Levi ME, et al. Naturally acquired West Nile virus encephalomyelitis in transplant recipients: clinical, laboratory, diagnostic, and neuropathological features. Arch Neurol 2004;61:1210–20.
- Kumar D, Prasad GVR, Zaltzman J, Levy GA, Humar A. Community-acquired West Nile virus infection in solid-organ transplant recipients. Transplantation 2004;77.
- Kusne S, Smilack J. Transmission of West Nile virus by organ transplantation. Liver Transplant 2005;11:239–41.
- Montgomery SP, Brown JA, Kuehnert MJ, et al. Transfusion-associated transmission of West Nile virus. United States 2003 through 2005. Transfusion 2006;46:2038–46.
- Murtagh B, Wadia Y, Messner G, Allison P, Harati Y, Delgado R. West Nile virus infection after cardiac transplantation. J Heart Lung Transplant 2005;24:774–6.
- Pealer LN, Marfin AA, Petersen LR, et al. Transmission of West Nile virus through blood transfusion in the United States in 2002. N Engl J Med 2003;349:1236–45.
- Ravindra K, Freifeld A, Kalil A, et al. West Nile virus associated encephalitis in recipients of renal and pancreas transplants: case series and literature review. Clin Infect Dis 2004;38:1257–60.
- Shephert JC, Subramanian A, Montgomery RA, et al. West Nile virus encephalitis in a kidney transplant recipient. Am J Transplant 2004;4:830–3.
- Trijzelaar B. Regulatory affairs and biotechnology in Europe: III. Introduction into good regulatory practice—validation of virus removal and inactivation. Biotherapy 1993;62:93–102.
- Hazelton PR, Gelderblom HR. Electron microscopy for rapid diagnosis of infectious agents in emergent situations. Emerg Infect Dis 2003;9:294–303.
- Johansen BV. Hazards related to EM-laboratory instrumentation. Ultrastruct Pathol 1984;7:219–25.
- CDC. Interim biosafety guidance for all individuals handling clinical specimens or isolates containing 2009-H1N1 influenza A virus (Novel H1N1), including vaccine strains. August 15, 2009. Available at: http://cdc.gov/h1n1flu/guidelines_labworkers.htm. 2-16-2010.
- Clinical and Laboratory Standards Institute. Performance of the bleeding time test; approved guideline—fourth edition (CLSI document H45-A2).Wayne, PA: Clinical and Laboratory Standards Institute; 2005.
- CDC. Workbook for designing, implementing, and evaluating a sharps injury prevention program. Atlanta, GA: US Department of Health and Human Services, CDC. Available at http://www.cdc.gov/sharpssafety/pdf/sharpsworkbook_2008.pdf.
- Clinical and Laboratory Standards Institute. Clinical flow cytometric analysis of neoplastic hematolymphoid cells; approved guideline—second edition (CLSI document H43-A2). Wayne, PA: Clinical and Laboratory Standards Institute; 2007.
- Clinical and Laboratory Standards Institute. Collection, transport, and processing of blood Specimens for testing plasma-based coagulation assays and molecular hemostasis assays; approved guideline—fifth edition (CLSI document H21-A5). Wayne, PA: Clinical and Laboratory Standards Institute; 2008.
- Clinical and Laboratory Standards Institute. Nucleic acid amplification assays for molecular hematopathology; approved guideline (CLSI document MM05-A). Wayne, PA: Clinical and Laboratory Standards Institute; 2003.
- Clinical and Laboratory Standards Institute. Collection, Transport, Preparation, and storage of specimens for molecular methods; approved guideline (CLSI document MM13-A). Wayne, PA: Clinical and Laboratory Standards Institute; 2005.
- Clinical and Laboratory Standards Institute. Procedures for the collection of diagnostic blood specimens by venipuncture; approved standard—sixth edition (CLSI document H03-A6). Wayne, PA: Clinical and Laboratory Standards Institute; 2007.
- Clinical and Laboratory Standards Institute. Procedures and devices for the collection of diagnostic capillary blood specimens; approved standard—sixth edition (CLSI document H04-A6). Wayne, PA: Clinical and Laboratory Standards Institute; 2008.
- Clinical and Laboratory Standards Institute. Procedures for the handling and processing of blood specimens for common laboratory tests; approved guideline—fourth edition (CLSI document H18-A4). Wayne, PA: Clinical and Laboratory Standards Institute; 2010.
- Selecting, evaluating, and using sharps disposal containers. Cincinnati, OH: US Department of Health and Human Services, CDC, National Institute for Occupational Safety and Health; 1998. Available at http://www.cdc.gov/niosh/pdfs/97-111.pdf.
- US Environmental Protection Agency. Selected EPA-registered disinfectants. Washington DC: US Environmental Protection Agency; 2009. Available at http://www.epa.gov/oppad001/chemregindex.htm.
- American Veterinary Medical Association. One health: a new professional imperative. Schaumburg, IL: American Veterinary Medical Association; 2008. Available at http://www.avma.org/onehealth.
- Torrey EF, Yolken RH. Beasts of the earth. New Brunswick, NJ: Rutgers University Press; 2005.
- Taylor LH, Latham SM, Woolhouse ME. Risk factors for human disease emergence. Philos Trans R Soc Lond B Biol Sci 2001;356:983–9.
- Biosafety and biosecurity in the veterinary microbiology laboratory and animal facilities. In: OIE manual of diagnostic tests and vaccines for terrestrial animals. Paris, France: World Organization of Animal Health (OIE), Office International Des Epizooties; 2008.
- The National Research Council, Committee on Hazardous Biological Substances in the Laboratory. Biosafety in the laboratory. Prudent practices for the handling and disposal of infectious materials. Washington, DC: National Academy Press; 1989. Available at http://www.nap.edu/openbook.php?isbn=0309039754.
- Immunization Action Coalition. Healthcare personnel vaccination recommendations. St. Paul, MN: Immunization Action Coalition; 2011. Available at http://www.immunize.org/catg.d/p2017.pdf.
- CDC. Human rabies prevention—United States, 2008: Recommendations of the Advisory Committee on Immunization Practices. MMWR 2008;57(No. RR-3).
- American Society for Microbiology. Sentinel level clinical microbiology laboratory guidelines. Washington, DC: American Society for Microbiology; 2010. Available at http://www.asm.org/?option=com_content&view=article&id=6342&Itemid=639.
- Gray LD, Snyder JW. Sentinel laboratory guidelines for suspected agents of bioterrorism and emerging infectious diseases. Packing and shipping infectious substances. Washington, DC: American Society for Microbiology; 2010. Available at http://www.asm.org/images/pdf/Clinical/ps11-15-10final.pdf.
- Gray LD, Snyder JW. Packing and shipping biological materials. In: Fleming DO, Hunt DL, eds. Biological safety: principles and practices, 4th edition. Washington, DC: ASM Press; 2006.
- International Air Transport Association. Dangerous goods regulations, 52nd. edition. Montreal, Canada: International Air Transport Association; 2011.
- CDC. Prevention and control of meningococcal disease. Recommendations of the Advisory Committee on Immunization Practices. MMWR 2005;54(No. RR-7).
- CDC. Laboratory-acquired meningococcal disease—United States, 2000. MMWR 2000;51:141–4.
- CDC. Guidelines for preventing the transmission of Mycobacterium tuberculosis in health-care settings, 2005. MMWR 2005;54(No. RR-17).
- CDC. Updated US Public Health Service guidelines for the management of occupational exposure to HIV and recommendations for postexposure prophylaxis. MMWR 2005;54(No, RR-9).
- CDC. Updated US Public Health Service guidelines for the management of occupational exposure to HBV, HCV, and HIV and recommendations for postexposure prophylaxis. MMWR 2001;50(No. RR-11).
- Clinical and Laboratory Standards Institute. Application of a quality management system model for laboratory services; approved guideline—third edition (CLSI document GP26-A3). Wayne, PA: Clinical and Laboratory Standards Institute; 2004.
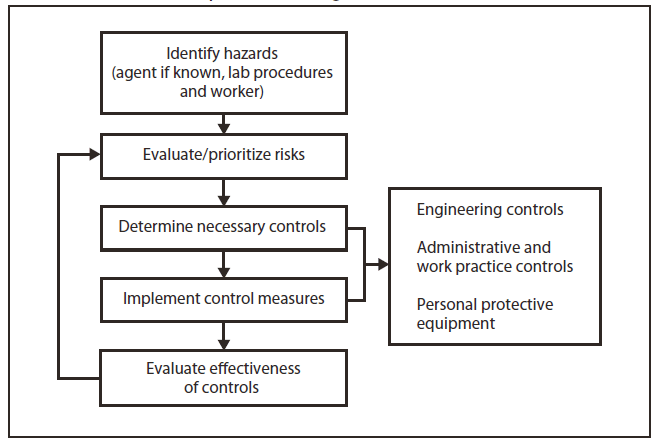
Texto alternativo: La figura es un diagrama de flujo que presenta el proceso de evaluación de riesgos para un peligro biológico
|
BSL |
Prácticas |
Equipos e instalaciones de seguridad |
|---|---|---|
|
1 |
Prácticas estándares de microbiología |
No se requiere ninguna |
|
2 |
• Prácticas de BSL 1 • Acceso limitado • Mostrar carteles de peligro biológico • Precauciones para objetos cortopunzantes • Personal capacitado sobre patógenos • Manual de seguridad disponible |
• BSC usado para procesamiento de muestras y tareas que produzcan aerosoles o salpicaduras • PPE (batas, guantes, protectores faciales) según sea necesario • Autoclave disponible |
|
3 |
• Prácticas de BSL-2 • Acceso controlado • Obtener muestra basal de suero del personal |
• Equipos/instalaciones BSL-2 • BSC usado para el trabajo con todas las muestras y cultivos • PPE (batas y mascarillas) según sea necesario • Flujo de aire con presión negativa • Puertas automáticas dobles • No recircula el aire de escape |
|
4 |
• Prácticas de BSL-3 • Cambio de ropa antes de entrar • Ducha al salir • Descontaminación de todos los residuos al salir |
• Equipos/instalaciones BSL-3 • Edificio o instalaciones separados • BSC y traje completo con presión positiva y suministro de aire para todos los procedimientos • Sistemas especializados de ventilación y descontaminación |
|
Abreviaturas: NIH = Institutos Nacionales de Salud; BSL = nivel de bioseguridad; BSC = gabinete de seguridad biológica; PPE = equipo de protección personal. Fuente: Adaptado de CDC/National Institutes of Health. Bioseguridad en laboratorios microbiológicos y biomédicos 5.ª ed. 2007 (1). |
||
|
RECUADRO 3. Patógenos de ganado con consecuencias mayores y agentes seleccionados |
|
Ganado Virus de la enfermedad equina africana Virus de la fiebre porcina africana Virus Akabane Virus de la gripe aviar (muy patogénico) Virus de la lengua azul (exótico) Encefalopatía espongiforme bovina Virus de la viruela del camello Virus clásico de la fiebre porcina Virus de la fiebre aftosa Virus de la viruela caprina Virus de la encefalitis japonesa Virus de la enfermedad de la piel abultada Virus Menangle Subespecies de Mycoplasma capricolum Colonia pequeña de micoides (Mycoids small colony, MmmSC) (pleuroneumonía bovina contagiosa) Virus de la peste de pequeños rumiantes Virus de la peste bovina Virus de la viruela ovina Virus de la enfermedad vesicular porcina Virus de la estomatitis vesicular (exótico); subtipos de Indiana VSV-IN2, VSV-IN3 Virus de la enfermedad virulenta de Newcastle Agentes que se superponen en el Departamento de Agricultura y el Departamento de Salud y Servicios Humanos de EE. UU. Bacillus anthracis Brucella abortus Brucella melitensis Brucella suis Burkholderia mallei Burkholderia pseudomallei Virus Hendra Virus Nipah Virus de la fiebre del valle del Rift Virus de la encefalitis equina venezolana Fuente: Adaptado de la lista de agentes y toxinas seleccionados del USDA/APHIS, 2010. (http://www.aphis.usda.gov/programs/ag_selectagent/ag_bioterr_toxinlist). |
|
TABLA 14. Guía de profilaxis previa a exposición a la rabia; Estados Unidos, 2008 |
|||
|---|---|---|---|
|
Categoría de riesgo |
Naturaleza del riesgo |
Poblaciones típicas |
Recomendaciones previas a la exposición |
|
Continuo |
El virus está presente en forma continua, a menudo en concentraciones altas. Es probable que no se reconozcan exposiciones específicas. Exposición por mordedura, no mordedura o aerosol. |
Trabajadores de laboratorios de investigación de la rabia; trabajadores que producen agentes biológicos para la rabia. |
Curso primario. Análisis serológico cada 6 meses; vacuna de refuerzo si el título de anticuerpos está por debajo del nivel aceptable.* |
|
Frecuente |
La exposición suele ser episódica, se reconoce la fuente pero la exposición también podría suceder sin ser reconocida. Exposición por mordedura, no mordedura o aerosol. |
Trabajadores de laboratorios de diagnóstico de rabia; espeleólogos, veterinarios y su personal, y trabajadores de control de animales y vida silvestre en áreas en las que la rabia es una enfermedad enzoótica. Todas las personas que manipulan murciélagos frecuentemente. |
Curso primario. Análisis serológico cada 2 años; vacuna de refuerzo si el título de anticuerpos está por debajo del nivel aceptable.* |
|
Infrecuente (mayor que el común de la población) |
La exposición casi siempre es episódica y se reconoce la fuente. Exposición por mordedura o no mordedura. |
Veterinarios y personal de control de animales que trabaja con animales terrestres en áreas en las que la rabia es poco frecuente a aislada. Estudiantes de veterinaria. Viajeros que visitan áreas en las que la rabia es enzoótica y el acceso inmediato a la atención médica adecuada, con agentes biológicos incluidos, es limitado. |
Curso primario. Ningún análisis serológico ni vacuna de refuerzo. |
|
Aislado (población en general)* |
La exposición siempre es episódica y se reconoce la fuente. Exposición por mordedura o no mordedura. El nivel mínimo aceptable de anticuerpos es la neutralización completa del virus a una dilución 1:5 del suero, medida por la prueba rápida de inhibición de focos fluorescentes. Se debe administrar una dosis de refuerzo si el título cae por debajo de ese nivel. |
Población de EE. UU. en general, incluidas las personas que viven en áreas en las que la rabia es epizoótica. |
No es necesaria la vacunación. |
|
Fuente: CDC. Prevención de la rabia en humanos (Human rabies prevention); Estados Unidos, 2008. MMWR 2008 (212). * El nivel mínimo aceptable de anticuerpos es la neutralización completa del virus a una dilución 1:5 del suero, medida por la prueba rápida de inhibición de focos fluorescentes. Se debe administrar una dosis de refuerzo si el título cae por debajo de ese nivel. |
|||
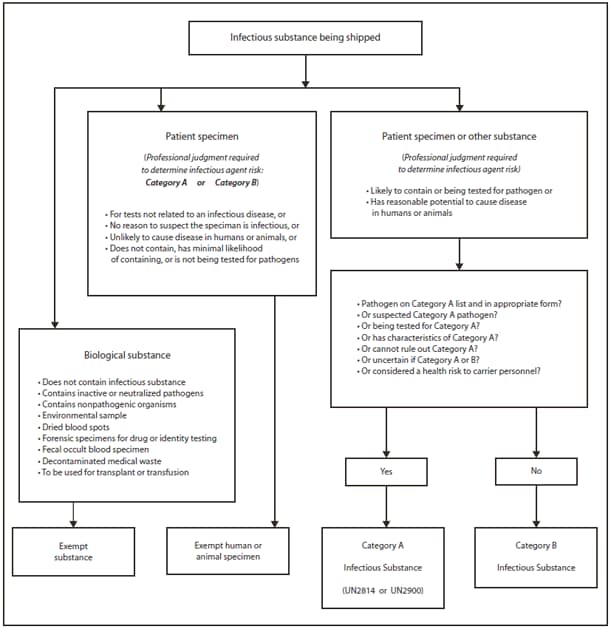
Texto alternativo: La figura es un diagrama de flujo que presenta el proceso para clasificar una sustancia infecciosa para su envío.
FIGURA 3. Embalaje externo con todos sus rótulos. El recipiente primario dentro del paquete contiene una sustancia biológica, sustancia infecciosa de la categoría B, y está acondicionado según la PI 650
Abreviatura: PI = Instrucciones de empaque.
Texto alternativo: La figura es un diagrama de un paquete para envío con los rótulos correspondientes para una sustancia infecciosa de la categoría B.
FIGURA 4. Embalaje externo con todos sus rótulos. El recipiente primario contiene una sustancia infecciosa de la categoría A en estado líquido, y está acondicionado según la PI 620
Abreviatura: PI = Instrucciones de empaque.
Texto alternativo: La figura es un diagrama de un paquete para envío con los rótulos correspondientes para una sustancia infecciosa de la categoría A en estado líquido.
Panel de especialistas (Blue Ribbon Panel) en cuestiones de seguridad del laboratorio clínico
Kathleen G. Beavis, MD, College of American Pathologists, Chicago, Illinois; Ellen Jo Baron, PhD, Stanford, California; William R. Dunn, MS, Greater New York Hospital Association Regional Laboratory Task Force, New York, New York; Larry Gray, PhD, American Society for Microbiology, Cincinnati, Ohio; Bill Homovec, MPH, American Clinical Laboratory Association, Burlington, North Carolina; Michael Pentella, PhD, Association of Public Health Laboratories, Iowa City, Iowa; Bruce Ribner, MD, Atlanta, Georgia; William A. Rutala, PhD, Chapel Hill, North Carolina; Daniel S. Shapiro, MD, Burlington, Massachusetts; Lisa A. Skodack-Jones, MT, Salt Lake City, Utah; Christine Snyder, American Society for Clinical Laboratory Science, Helena, Montana; Robert L. Sunheimer, MS, American Society for Clinical Pathology, Syracuse, New York; Christina Z. Thompson, MS, American Biological Safety Association, Greenfield, Indiana.
Personal de los CDC: Nancy L. Anderson, MMSc; Rex Astles, PhD; D. Joe Boone, PhD; David S. Bressler, MS; Roberta Carey, PhD; Casey Chosewood, MD; Mitchell L. Cohen, MD; Judy Delaney, MS; Thomas L. Hearn, DrPH; Kathleen F. Keyes, MS; Davis Lupo, PhD; Robert Martin, DrPH; Alison C. Mawle, PhD; Terra McConnel; J. Michael Miller, PhD; Shana Nesby, DVM; Janet K. Nicholson, PhD; John P. O'Connor, MS; Anne Pollock; John C. Ridderhof, DrPH; Pamela Robinson; Elizabeth G. Weirich, MS; Ae S. Youngpairoj.
El uso de marcas y de sus fuentes comerciales es solamente con fines de identificación y no implica respaldo alguno por parte del Departamento de Salud y Servicios Humanos de los EE. UU. |
Todos los artículos en versión HTML del MMWR son conversiones electrónicas de documentos originales en formatos impresos. Esta conversión podría generar errores en la conversión de caracteres o de formato en la versión HTML. Los usuarios deben remitirse a la versión electrónica en formato PDF (http://www.cdc.gov/mmwr) o a la versión original impresa del MMWR para obtener versiones para imprimir del texto original, sus figuras y tablas. Escriba a la siguiente dirección para obtener una copia impresa del documento original: Superintendent of Documents, U.S. Government Printing Office (GPO), Washington, DC 20402-9371; teléfono: (202) 512-1800 Pregunte a la GPO sobre los precios actuales.
**Las preguntas o mensajes sobre errores de formato deben dirigirse a mmwrq@cdc.gov.


