Persons using assistive technology might not be able to fully access information in this file. For assistance, please send e-mail to: mmwrq@cdc.gov. Type 508 Accommodation and the title of the report in the subject line of e-mail.
Uso de la vacuna monovalente contra la influenza A (H1N1) 2009
Recomendaciones del Comité Asesor sobre Prácticas de Inmunización (ACIP), 2009
Resumen
Este informe presenta las recomendaciones del Comité Asesor sobre Prácticas de Inmunización (ACIP) de los CDC con respecto al uso de la vacuna contra la infección por el virus nuevo de la influenza A (H1N1). Se ha publicado previamente información sobre vacunación contra la influenza estacional en (CDC. Prevención y control de la influenza estacional mediante la vacunación: recomendaciones del Comité Asesor sobre Prácticas de Inmunización [ACIP], 2009. MMWR 2009;58[No. RR-8]). Las vacunas contra la infección por el virus nuevo de la influenza A (H1N1) no se han aprobado todavía; no obstante, se anticipa la autorización para mediados de octubre del 2009. El 29 de julio del 2009, el ACIP revisó los datos clínicos y epidemiológicos para determinar qué grupos de la población deberían vacunarse inicialmente. El ACIP también tuvo en cuenta el suministro proyectado de vacunas que se espera esté disponible cuando se tenga la vacuna y el aumento esperado en la disponibilidad de vacunas durante los 6 meses siguientes. Estas recomendaciones tienen como fin brindar información a los programas de vacunación y proveedores de vacunas para ayudarlos en la planificación y para informar a los proveedores y al público sobre los grupos específicos de la población, que comprenden unos 159 millones de personas, a quienes se recomienda dar prioridad en la administración de la vacuna monovalente contra la influenza A (H1N1) 2009. El principio que rige dichas recomendaciones es el de vacunar a tantas personas como sea posible y lo más rápido que se pueda. Los esfuerzos de vacunación deben empezar tan pronto la vacuna esté disponible. Los funcionarios de salud local y estatal y los proveedores de vacunas deben tomar decisiones sobre la administración y distribución de las vacunas de acuerdo a la situación local y del estado. Los puntos a destacar en estas recomendaciones son: 1) identificar cinco grupos iniciales a los que se orientarán los esfuerzos de vacunación (mujeres embarazadas, personas que viven con bebés <6 meses de edad o que cuidan de ellos, personal de servicios de salud y servicios médicos de emergencia, niños y jóvenes de 6 meses --24 años de edad y personas entre los 25--64 años de edad que tengan afecciones médicas que las ponen en un riesgo mayor de sufrir complicaciones debido a la influenza), 2) establecer un subgrupo prioritario dentro de estos grupos iniciales que deba recibir la vacuna en caso de que inicialmente la vacuna no sea suficiente para abastecer la demanda y 3) ofrecer directrices para el uso de la vacuna en otros grupos de adultos de la población según aumente la disponibilidad de la vacuna. Los proveedores de vacunas y de atención médica deben estar alertas ante anuncios e información adicional que emitan los departamentos de salud local y estatal y los CDC con respecto a la vacunación contra la infección por el virus nuevo de la influenza A (H1N1). Se dispone de información adicional en los departamentos de salud local y estatal, así como en el sitio web de los CDC sobre influenza (http://www.cdc.gov/flu).
Introducción
En abril del 2009, se determinó que un nuevo virus de la influenza A (H1N1), el virus nuevo de la influenza A (H1N1), era la causa etiológica de influenza en dos niños en los Estados Unidos, durante marzo y abril del 2009 (1,2) y de brotes de enfermedades respiratorias en México (3). Este virus, en semanas, se propagó a comunidades de todo Norteamérica y se identificó en muchas áreas del mundo para mayo del 2009 (4,5). El 11 de junio del 2009, la Organización Mundial de la Salud (OMS) declaró una pandemia mundial, lo que indicaba una transmisión sin contener a nivel de la comunidad del virus nuevo de la influenza A (H1N1) en varias áreas del mundo (5). La transmisión mundial del virus de la nueva influenza A (H1N1) ha continuado desde junio en los hemisferios Norte y Sur (6). Es probable que la transmisión persista y pueda aumentar en el hemisferio Norte durante el otoño y el invierno. En contraste con lo que ocurre con la influenza estacional, los hallazgos actuales indican que se han presentado pocos casos graves de infección por el virus de la nueva influenza A (H1N1) en personas de mayor edad y las tasas de hospitalización más altas debido al virus han ocurrido en personas <65 años de edad (7). Los signos y síntomas de la infección por la nueva influenza A (H1N1) son similares a los de la influenza estacional y se requieren pruebas de diagnóstico específicas para distinguir los virus de la nueva influenza A (H1N1) del virus de la influenza estacional (7; CDC, datos sin publicar, 2009).
La vacunación contra la influenza es el método más eficaz para prevenir esta enfermedad y las complicaciones relacionadas con la influenza. Sin embargo, las vacunas actuales contra la influenza estacional probablemente no proporcionen protección contra el virus de la influenza A (H1N1) (8). Se están fabricando vacunas específicas contra el virus de la nueva influenza A (H1N1), y se espera que las vacunas aprobadas estén disponibles en los Estados Unidos para mediados de octubre del 2009 (9). Sin embargo, el suministro inicial de estas vacunas podría no ser suficiente para abastecer la demanda de vacunación. Por esta razón, el Comité Asesor sobre Prácticas de Inmunización (ACIP) recomienda que ciertos grupos que tienen un riesgo más alto de infección o de sufrir complicaciones relacionadas con la enfermedad sean los grupos a vacunar inicialmente. Los puntos a destacar en estas recomendaciones son: 1) identificar cinco grupos iniciales a los que se orientarán los esfuerzos de vacunación (mujeres embarazadas, personas que viven con bebés <6 meses de edad o que cuidan de ellos, personal de servicios de salud y servicios médicos de emergencia, niños y jóvenes de 6 meses --24 años de edad y personas entre los 25--64 años de edad que tengan afecciones médicas que las ponen en un riesgo mayor de sufrir complicaciones debido a la influenza), 2) establecer un subgrupo prioritario dentro de estos grupos iniciales que deba recibir la vacuna en caso de que inicialmente la vacuna no sea suficiente para abastecer la demanda y 3) ofrecer directrices para el uso de la vacuna en otros grupos de adultos de la población según aumente la disponibilidad de la vacuna. Dado que el virus de la nueva influenza A (H1N1) continúa causando casos de enfermedad en los Estados Unidos y en todo el mundo, el enfoque principal de los esfuerzos de vacunación debe ser vacunar lo más rápido que se pueda a tantas personas como sea posible de los grupos recomendados, una vez que la vacuna esté disponible. A medida que aumente la disponibilidad de vacunas, se recomienda vacunar a otros grupos. El ACIP revisará los nuevos datos clínicos y epidemiológicos tan pronto estén disponibles y podría modificar estas recomendaciones.
Métodos
El ACIP brinda recomendaciones a los CDC sobre el control y la prevención de las enfermedades que se pueden prevenir con vacunas en la población civil de los Estados Unidos. Durante abril--julio del 2009, el grupo de trabajo sobre influenza del ACIP sostuvo reuniones frecuentes a través de teleconferencias para revisar la nueva información sobre la propagación del virus nuevo de la influenza A (H1N1). En el proceso de creación de las recomendaciones para la vacunación a evaluar por todos los miembros del ACIP, se tomaron en cuenta la carga creciente de enfermedades causadas por el virus, los grupos etarios y de riesgo más afectados, el avance en la creación de las vacunas, el suministro anticipado de vacunas disponibles y varias estrategias posibles de vacunación. Las deliberaciones del ACIP tuvieron en cuenta las consultas realizadas a otras agencias federales y un análisis de las directrices para la distribución de las vacunas creadas como parte de la preparación para una pandemia de influenza durante 2007--2008 (10).
Las reuniones iniciales del comité en pleno relacionadas con el virus nuevo de la influenza A (H1N1) se realizaron durante una sesión pública del ACIP del 25 al 26 de junio del 2009. En una reunión pública posterior que tuvo lugar el 29 de julio del 2009, el ACIP emitió recomendaciones para el uso de la vacuna monovalente contra la influenza A (H1N1) 2009 que se encuentra en la actualidad en producción para su distribución en el mercado estadounidense. La información presentada en estas reuniones se encuentra disponible en http://www.cdc.gov/vaccines/recs/acip/slides-jun09.htm y http://www.cdc.gov/vaccines/recs/acip/slides-july09-flu.htm.
Antecedentes
En abril del 2009 se identificaron por primera vez personas infectadas por el virus nuevo de la influenza A (H1N1) (1) y se han reportado infecciones por este virus en todo el mundo (5). Debido a que los análisis serológicos indican que una gran mayoría de la población es vulnerable al virus nuevo de la influenza A (H1N1), existe una posibilidad considerable de que la infección se propague ampliamente (2). El virus nuevo de la influenza A (H1N1) es genética y antigénicamente distinto a otros virus de la influenza A (H1N1) que se encuentran en circulación desde 1977 (2). Hasta el 1.o de agosto del 2009, los virus nuevos de la influenza A (H1N1) circulantes en el mundo parecen ser antigénicamente similares (11).
Cuadro clínico
Los signos y síntomas de la infección por el virus nuevo de la influenza A (H1N1) son similares a los de la influenza estacional (7,12). El diagnóstico definitivo de la infección por el virus nuevo de la influenza A (H1N1) requiere de pruebas de detección específicas para los virus H1N1 mediante pruebas de transcripción reversa de reacción en cadena de la polimerasa en tiempo real o cultivos virales (7,13). Las pruebas rápidas para el diagnóstico de influenza (RIDT, por sus siglas en inglés) que se usan para la influenza estacional pueden en algunos casos detectar el virus nuevo de la influenza A (H1N1), pero la sensibilidad de la prueba se ha estimado en 40%--70% (13,14). Un resultado negativo en la RIDT no debe usarse para descartar el diagnóstico de infección por el virus nuevo de la influenza A (H1N1) (13).
La distribución por edad de la enfermedad confirmada, la gravedad de la enfermedad y la prevalencia de factores médicos de riesgo entre las personas con enfermedades graves ha sido constante en muchos países con el paso del tiempo. Hasta el 31 de julio del 2009, la mediana de edad de las personas con infecciones confirmadas por laboratorio en los Estados Unidos fue de 12 años y la incidencia de infección más alta correspondió a personas de 5--24 años de edad (7,11). La incidencia de infección más baja ocurrió en personas ≥65 años de edad. Se han notificado hallazgos similares en otros países (15).
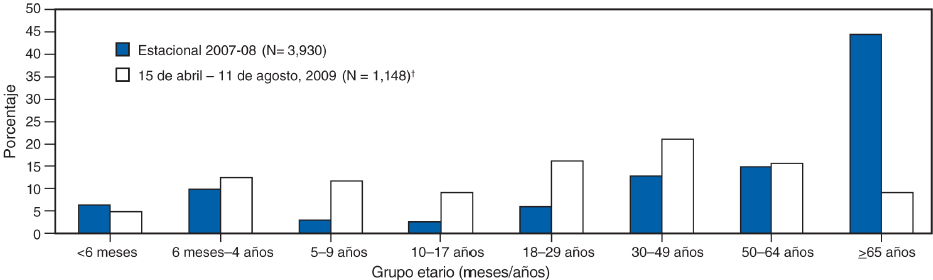
Una comparación en la distribución por edad de las personas hospitalizadas con casos de nueva influenza A (H1N1) confirmados por laboratorios también muestra una sorprendente diferencia con la influenza estacional (Figura). Hasta el 31 de julio del 2009, la mediana de edad de las personas hospitalizadas por la infección del virus nuevo de la influenza A (H1N1) confirmada por laboratorio fue de 20 años, y la incidencia de hospitalización fue más alta en niños pequeños <4 años de edad (11; CDC, datos sin publicar, 2009). Solo 282 (5%) de las 5,514 hospitalizaciones y 29 (8%) de las 353 muertes reportadas ocurrieron en personas ≥65 años de edad (CDC, datos sin publicar, 2009). La mediana de edad de las personas que murieron debido a la infección por el virus nuevo de la influenza A (H1N1) fue de 37 años. En contraste, en múltiples estudios sobre la influenza estacional, las tasas de hospitalización y mortalidad han sido más altas en personas ≥65 años de edad y se estima que el 90% de las muertes relacionadas con la influenza estacional así como el 60% de las hospitalizaciones se presentan en adultos ≥65 años de edad (16,17). Hasta el 31 de julio del 2009, solo 282 (5%) de las 5,514 hospitalizaciones y 29 (8%) de las 353 muertes reportadas atribuidas a la infección por el virus nuevo de la influenza A (H1N1) correspondieron a personas ≥65 años de edad (CDC, datos sin publicar, 2009). Las tasas acumulativas de hospitalización por la nueva influenza A (H1N1) para abril--julio del 2009 se aproximaron o excedieron las tasas acumulativas típicas del final de temporada de la influenza estacional en los niños en edad escolar y los adultos de 18--49 años de edad en las áreas de vigilancia del Programa contra las Infecciones Emergentes* (EIP) (11). Sin embargo, para las personas ≥65 años de edad, estas tasas acumulativas de hospitalización son <20% de las tasas observadas por lo general durante el invierno en las personas de este grupo etario. La mediana de edad de hospitalización de pacientes durante la temporada de influenza 2007--08 en las áreas de vigilancia del EIP fue de 59 años, comparada con la mediana de edad de 26 años para personas hospitalizadas en estas áreas durante abril--julio del 2009 (CDC, datos sin publicar, 2009). Además, no se han reportado brotes atribuibles a los virus nuevos de la influenza A (H1N1) en adultos de edad avanzada en instituciones de cuidados prolongados, aunque se identificó la nueva influenza A (H1N1) en personal de atención médica de esos establecimientos que laboraron estando enfermos.
Los factores médicos de riesgo para sufrir una infección grave son similares a los que se han identificado en estudios anteriores sobre la influenza estacional (12). En un estudio de serie de casos de 179 pacientes hospitalizados con infección por el virus nuevo de la influenza A (H1N1) confirmada en laboratorio, 117 (65%) pacientes tenían un factor médico de riesgo previamente asociado a una infección grave en estudios sobre la influenza estacional (p. ej., enfermedades cardiacas, respiratorias, renales, hepáticas crónicas; cáncer o inmunodepresión; o embarazo) (12,18; CDC, datos sin publicar, 2009). Se han reportado muertes debido a la nueva influenza A (H1N1) en mujeres embarazadas. En una serie de casos, la incidencia de hospitalización debido a la infección confirmada por el virus nuevo de la influenza A (H1N1) en mujeres embarazadas fue cuatro veces más alta que en el resto de la población (19). También se ha observado obesidad (definida como un índice de masa corporal [IMC] ≥30) y obesidad morbosa (IMC ≥40) en pacientes hospitalizados en algunas series de casos (20,21). Sin embargo, la mayoría de estos pacientes tenían otros factores médicos de riesgo, y en la actualidad se están realizando investigaciones para determinar si la obesidad o la obesidad morbosa es un factor de riesgo independiente de una infección grave.
Datos epidemiológicos y transmisión
La epidemiología de la infección por el virus nuevo de la influenza A (H1N1) se está investigando y las características epidemiológicas pueden cambiar al continuar la transmisión. Los brotes en entornos donde se congregan personas jóvenes (p. ej., escuelas, universidades y campamentos de verano) han sido una fuente de transmisión frecuente en la comunidad (22,23). Durante la primavera y el verano del 2009, muchas escuelas y campamentos de verano en los Estados Unidos cerraron temporalmente debido a la preocupación por los brotes, lo que causó un impacto significativo en la comunidad (24).
El número de infecciones confirmadas por laboratorio subestima la incidencia de la enfermedad causada por la infección por el virus nuevo de la influenza A (H1N1) porque las pruebas de detección en laboratorio se han concentrado en las personas con infecciones más graves. En forma similar a lo que ocurre en la práctica clínica de la influenza estacional, a muchas personas saludables con probable infección por el virus nuevo de la influenza A (H1N1) no se les hacen pruebas de detección porque su enfermedad no requiere de intervenciones médicas o diagnósticos específicos. Encuestas en la comunidad y encuestas telefónicas en la población realizadas en áreas con brotes focalizados de infecciones por el virus nuevo de la influenza A (H1N1) han identificado enfermedad seudogripal autorreportada (ILI, por sus siglas en inglés) en aproximadamente un 6% de la población de las áreas encuestadas (CDC, datos sin publicar, 2009). En junio del 2009, el Departamento de Salud de la Ciudad de Nueva York City realizó una encuesta en hogares en la cual se indicó que el 7% de los neoyorquinos reportó síntomas seudogripales (fiebre acompañada de tos o dolor de garganta) durante mayo 1--20 del 2009; dado que otros indicadores de ILI (p. ej., consultas a médicos por enfermedades respiratorias) mostraron transmisión continua y en aumento en la comunidad de la ciudad de Nueva York, es probable que las encuestas siguientes muestren que se presentaron tasas aún más altas de síntomas seudogripales autorreportados durante mayo--junio del 2009 (25).
Se han reportado casos de transmisión del virus de nuevo de la influenza A (H1N1) en entornos médicos. De 11 miembros del personal de servicios de salud (HCP, por sus siglas en inglés) con casos probables o posibles de contagio de paciente a personal e información disponible sobre uso del equipo de protección individual, solo tres reportaron usar siempre una mascarilla quirúrgica o un respirador N95 en una de las series de casos (26). También se ha identificado transmisión de la infección por el virus nuevo de la influenza A (H1N1) a personal de servicios de salud en entornos comunitarios, lo cual aumenta la posibilidad de que este personal infectado transmita los virus a pacientes en entornos médicos (26).
Vacuna contra la infección por el virus nuevo de la influenza A (H1N1)
Datos limitados de los análisis serológicos de personas vacunadas contra la influenza estacional indican que las vacunas contra la influenza estacional no ofrecerán protección contra los virus nuevos de la influenza A (H1N1). En los adultos, se detectaron anticuerpos de reacción cruzada al virus nuevo de la influenza A (H1N1) en valores correlativos de inmunidad a la enfermedad en estudios sobre la vacuna contra la influenza estacional, en el 6%--9% de las personas de 18--64 años de edad y en el 33% de aquellas >60 años de edad. Ninguno de los niños a los que se hicieron pruebas presentó anticuerpos de reacción cruzada al virus nuevo de la influenza A (H1N1). Los valores de anticuerpos de reacción cruzada al virus nuevo la influenza A (H1N1) no aumentaron después de la administración de la vacuna contra la influenza estacional (2,8).
Las vacunas contra la infección por el virus nuevo de la influenza A (H1N1) se están produciendo con métodos similares a los utilizados para la fabricación de las vacunas contra la influenza estacional. La otorgación de licencias para la fabricación de vacunas contra el virus nuevo de la influenza A (H1N1) seguirá los mismos estándares utilizados para las vacunas contra la influenza estacional, como se hace anualmente cuando se cambian las cepas de la vacuna contra la influenza estacional. Estarán disponibles inicialmente formulaciones vivas atenuadas e inactivadas de la vacuna monovalente contra la influenza A (H1N1) 2009; estas vacunas no contendrán adyuvantes, en forma similar a lo que se hace con las vacunas contra la influenza estacional. La Administración de Drogas y Alimentos (FDA) y la OMS han seleccionado la cepa A/California/07/2009 (H1N1) para que se use en las vacunas en producción en la actualidad.
Las personas no vacunadas anteriormente <9 años de edad requieren 2 dosis de la vacuna contra la influenza estacional para inducir inmunidad, ya que los niños pequeños por lo general han tenido una exposición limitada a los virus de la influenza y no tienen sensibilización inmunitaria (es decir, no tienen anticuerpos preexistentes) (12). La falta de anticuerpos preexistentes de reacción cruzada al virus nuevo de la influenza A (H1N1) en niños y adultos jóvenes aumenta la posibilidad de que se necesiten 2 dosis de la vacuna (por lo general, separadas por un intervalo de ≥21 días) con el fin de brindar la protección necesaria para las personas de este grupo etario. Los estudios en curso brindarán información adicional sobre la respuesta inmunitaria a la vacuna, incluso de los grupos que necesitarán recibir 2 dosis. Los CDC publicarán la información actualizada en el MMWR o en http://www.cdc.gov/flu.
También se están estudiando varias vacunas que contienen un adyuvante, pero probablemente no estén disponibles inicialmente. Lo más probable es que estas vacunas se utilicen con una Autorización para Uso de Emergencia.† Se emitirán directrices adicionales si se dispone de vacunas con adyuvantes.
Uso recomendado de la vacuna monovalente contra la influenza A (H1N1) 2009
El ACIP recomienda que los esfuerzos de vacunación se concentren en un principio en cinco grupos iniciales (Casilla) compuestos por personas con un riesgo más alto de contraer influenza o sufrir complicaciones relacionadas con esta enfermedad, personas que tengan probabilidad de estar en contacto con virus de la influenza como parte de su trabajo y que puedan transmitir los virus de la influenza a otras en entornos médicos, y personas que tengan contacto cercano con bebés <6 meses (que son muy pequeños para recibir la vacuna). En el caso de que el suministro de vacunas no sea suficiente para abastecer la demanda inicial, se debe dar prioridad a un subgrupo dentro de estos grupos iniciales a vacunar (Casilla).
Grupos a vacunar inicialmente
Cuando la vacuna esté disponible por primera vez, el ACIP recomienda que los programas de vacunación y proveedores de vacunas la administren a personas en los siguiente cinco grupos a vacunar inicialmente (el orden no indica prioridad de vacunación):
- mujeres embarazadas,
- personas que viven con bebés <6 meses o que cuidan de ellos (p. ej., padres, hermanos y proveedores de cuidados infantiles),
- personal de servicios de salud y de servicios médicos de emergencia,§
- personas de 6 meses--24 años de edad y
- personas de 25--64 años que tengan afecciones que las ponen en riesgo mayor de sufrir complicaciones relacionadas con la influenza.¶
Estos cinco grupos a vacunar inicialmente están compuestos de unos 159 millones de personas en los Estados Unidos. Este cálculo no representa en forma precisa las personas que pueden estar incluidas en más de una categoría (p. ej., un trabajador del sector de la salud que tenga una afección de alto riesgo). Los programas de vacunación y los proveedores de vacunas deben empezar a vacunar a las personas de todos estos grupos tan pronto como la vacuna esté disponible.
Subgrupo de los grupos a vacunar si se dispone de cantidades limitadas de la vacuna
Las proyecciones actuales de la cantidad inicial de vacunas disponibles indican que en la mayoría de las áreas del país no será necesario establecer un subgrupo extraído de los cinco grupos de personas a vacunar inicialmente. Sin embargo, la demanda y el suministro inicial de las vacunas pueden variar considerablemente de acuerdo al área geográfica. Si el suministro inicial de la vacuna no es adecuado para abastecer la demanda de vacunas en los cinco grupos especificados anteriormente, el ACIP recomienda que se dé prioridad en la vacunación de los siguientes subgrupos de personas, hasta que aumente la disponibilidad de la vacuna (el orden de los grupos no indica prioridad):
- mujeres embarazadas,
- personas que viven con bebés <6 meses o que cuidan de ellos (p. ej., padres, hermanos y proveedores de cuidados infantiles),
- personal de servicios de salud y de servicios médicos de emergencia que tengan contacto directo con pacientes y material infeccioso.
- niños de 6 meses--4 años de edad y
- niños y adolescentes de 5--18 años de edad que tengan afecciones que los ponen en riesgo mayor de sufrir complicaciones relacionadas con la influenza.
Este subgrupo de los cinco grupos a vacunar inicialmente representa aproximadamente 42 millones de personas en los Estados Unidos. Los programas de vacunación y los proveedores de vacunas deben dar prioridad a este subgrupo solo si el suministro de vacunas es muy limitado para iniciar la vacunación de todas las personas de los cinco grupos a vacunar inicialmente.
Ampliación de los esfuerzos de vacunación a personas no incluidas en los grupos a vacunar inicialmente
Las decisiones acerca de aumentar la vacunación para incluir grupos que no estaban en los cinco grupos a vacunar inicialmente se deben hacer a nivel local, dado que la disponibilidad de la vacuna y la demanda podrían variar considerablemente de un área a otra. Una vez que los programas de vacunación y los proveedores de vacunas estén cumpliendo con la demanda para las personas de los cinco grupos iniciales, la cobertura se debe ampliar a las personas de 25--64 años de edad. Las decisiones sobre ampliar o establecer prioridades de vacunación deben hacerse de acuerdo a las circunstancias locales según el juicio de los funcionarios de salud local y estatal y de los proveedores de atención médica. Los CDC y otras agencias de salud pública evaluarán el suministro de vacunas en forma continua a lo largo del periodo de fabricación. Los CDC y las autoridades de salud local y estatal informarán a los proveedores y al público en general si existen indicios de retrasos sustanciales en el suministro o si este no es adecuado.
Los estudios actuales indican que el riesgo de infección en las personas de ≥65 años es menor que el riesgo en las personas de los grupos de edades más jóvenes. Se recomienda la ampliación de las directrices de vacunación para incluir adultos ≥65 años de edad solo después de evaluar la disponibilidad y demanda de la vacuna a nivel local. Una vez que se abastezca la demanda de vacunas para los grupos de edades más jóvenes, se debe ampliar la vacunación a todas las personas ≥65 años de edad. Esta recomendación se podría reevaluar si los nuevos datos epidemiológicos, inmunológicos o de ensayos clínicos lo ameritan y dentro del contexto de una necesidad global de la vacuna.
El ACIP emite las siguientes recomendaciones adicionales sobre el uso de la vacuna monovalente contra la influenza A (H1N1) 2009:
- No se ha establecido el número de dosis de la vacuna que se requieren para inmunizar contra la nueva influenza A (H1N1). Debido a que se espera que la disponibilidad de la vacuna aumente con el tiempo, no se deben reservar vacunas para los pacientes que han recibido la primera dosis y puedan requerir de una segunda.
- Se permite la aplicación simultánea de las vacunas inactivadas contra los virus de la influenza estacional y la nueva influenza A (H1N1), siempre y cuando se apliquen en diferentes localizaciones anatómicas. Sin embargo, no se recomienda la administración simultánea de vacunas contra la influenza estacional y la influenza A (H1N1) fabricadas con virus atenuados.
- Todas las personas a las que se recomiende recibir la vacuna contra la influenza estacional, incluso aquellas ≥65 años de edad, deben recibirla tan pronto esté disponible. Las recomendaciones para el uso de la vacuna contra la influenza estacional 2009--10 se publicaron con anterioridad (12).
Referencias bibliográficas
- CDC. Infecciones por influenza porcina tipo A (H1N1) en dos niños---sur de California, marzo a abril del 2009. MMWR 2009;58:400--2.
- Garten RJ, Davis CT, Russell CA, et al. Antigenic and genetic characteristics of swine-origin 2009 A(H1N1) influenza viruses circulating in humans. Science 2009;325:197--201.
- CDC. Outbreak of swine-origin influenza A (H1N1) virus infection---Mexico, March--April 2009. MMWR 2009;58:467--70.
- CDC. Update: novel influenza A (H1N1) virus infections---worldwide, May 6, 2009. MMWR 2009;58:453--8.
- World Health Organization. New influenza A (H1N1) virus: global epidemiological situation, June 2009. Wkly Epidemiol Rec 2009;84:249--57.
- Fraser C, Donnelly CA, Cauchemez S, et al. Pandemic potential of a strain of influenza A (H1N1): early findings. Science 2009;324:1557--61.
- Dawood FS, Jain S, Finelli L, et al. Emergence of a novel swine-origin influenza A (H1N1) virus in humans. N Engl J Med 2009;360:2605--15.
- CDC. Serum cross-reactive antibody response to a novel influenza A (H1N1) virus after vaccination with seasonal influenza vaccine. MMWR 2009;58:521--4.
- Robinson R. H1N1 vaccine products and production. In: ACIP presentation slides: special July 2009 meeting [Presentation]. Atlanta, GA: US Department of Health and Human Services, CDC; 2009. Available at http://www.cdc.gov/vaccines/recs/acip/slides-july09-flu.htm.
- US Department of Health and Human Services, US Department of Homeland Security. Guidance on allocating and targeting pandemic influenza vaccine. Washington, DC: US Department of Health and Human Services, US Department of Homeland Security; 2008. Available at http://www.pandemicflu.gov/vaccine/allocationguidance.pdf.
- CDC. Flu activity and surveillance. Atlanta, GA: US Department of Health and Human Services, CDC; 2009. Available at http://www.cdc.gov/flu/weekly/fluactivity.htm.
- CDC. Prevention and control of seasonal influenza with vaccines: recommendations of the Advisory Committee on Immunization Practices (ACIP), 2009. MMWR 2009;58(No. RR-8).
- CDC. Evaluation of rapid influenza diagnostic tests for detection of novel influenza A (H1N1) virus---United States, 2009. MMWR 2009;58:826--9.
- Faix DJ, Sherman SS, Waterman SH. Rapid-test sensitivity for novel swine-origin influenza A (H1N1) virus in humans. N Engl J Med 2009; 361:728--9.
- Finelli L. Influenza surveillance [Presentation]. Atlanta, GA: US Department of Health and Human Services, CDC; 2009. Available at http://www.cdc.gov/vaccines/recs/acip/downloads/mtg-slides-jun09/15-2-inf.pdf.
- Thompson WW, Shay DK, Weintraub E, et al. Influenza-associated hospitalizations in the United States. JAMA 2004;292:1333--40.
- Thompson WW, Shay DK, Weintraub E, et al. Mortality associated with influenza and respiratory syncytial virus in the United States. JAMA 2003;289:179--86.
- Kelly H, Grant K, Williams S, Smith D. H1N1 swine origin influenza infection in the United States and Europe in 2009 may be similar to H1N1 seasonal influenza infection in two Australian states in 2007 and 2008. Influenza Other Respi Viruses 2009;3:183--8.
- Jamieson DJ, Honein MA, Rasmussen SA, et al. H1N1 2009 influenza virus infection during pregnancy in the USA. Lancet 2009;374:451--8.
- CDC. Hospitalized patients with novel influenza A (H1N1) virus infection---California, April--May, 2009. MMWR 2009;58:536--41.
- CDC. Intensive-care patients with severe novel influenza A (H1N1) virus infection---Michigan, June 2009. MMWR 2009;58:749--52.
- CDC. Swine-origin influenza A (H1N1) virus infections in a school---New York City, April 2009. MMWR 2009;58:470--2.
- World Health Organization. Preliminary information important for understanding the evolving situation: novel influenza A (H1N1) briefing note 4. Geneva, Switzerland: World Health Organization; 2009. Available at http://www.who.int/csr/disease/swineflu/notes/h1n1_situation_20090724/en/index.html.
- CDC. Technical report for state and local public health officials and school administrators on CDC guidance for school (K--12) responses to influenza during the 2009--2010 school year. Atlanta, GA: US Department of Health and Human Services, CDC; 2009. Available at http://www.cdc.gov/h1n1flu/schools/technicalreport.htm.
- New York City Department of Health and Mental Hygiene. Novel H1N1 influenza update: June 12, 2009. In: New York City Department of Health and Mental Hygiene, Health Alert #22. New York, NY: New York City Department of Health and Mental Hygiene; 2009. Available at http://www.nyc.gov/html/doh/downloads/pdf/cd/2009/09md22.pdf.
- CDC. Novel influenza A (H1N1) virus infections among health-care personnel---United States, April--May 2009. MMWR 2009;58:641--5.
- CDC. Influenza vaccination of health-care personnel: recommendations of the Healthcare Infection Control Practices Advisory Committee (HICPAC) and the Advisory Committee on Immunization Practices (ACIP). MMWR 2006;55(No. RR-2).